(1)写出下列化合物的结构简式
2,2,3,3,-四甲基戊烷:__________________________。
(2)①写出Na2CO3溶液与AlCl3溶液反应的离子方程__________________________。
②写出由甲苯制备TNT的化学方程式:__________________________。
③Na2CO3溶液显碱性,用离子方程式表示原因___________,其溶液中离子浓度大小顺序为___________。
(3)除去括号中的杂质,填上适宜的试剂和提纯方法
乙醇(水):__________、_________。
(4)甲烷燃料电池(在KOH环境中)的负极的电极反应式:___________________。
(5)将煤转化为煤气的主要化学反应为:C(s)+H2O(g)===CO(g)+H2(g)
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
H2(g)+ O2(g)===H2O(g) ΔH=-242.0 kJ/mol
O2(g)===H2O(g) ΔH=-242.0 kJ/mol
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ/mol
O2(g)===CO2(g) ΔH=-283.0 kJ/mol
根据以上数据,写出C(s)与水蒸气反应的热化学方程______________________。
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A. <1.0×10-7mol/L <1.0×10-7mol/L |
| B.c(Na+)=c(HCO3-)+ c(CO32-)+ c(H2CO3) |
| C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2c(CO32-) |
| D.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-) |
下列说法中正确的是( )
| A.在Na3PO4溶液中,c(Na+)是c(PO43-)的3倍 |
| B.pH=3的盐酸中,其c(H+)是pH=1的盐酸中的c(H+)的3倍 |
| C.0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH-)相等 |
| D.在25℃时,无论酸性、中性还是碱性溶液中,其c(H+)和c(OH-)的乘积都等于1×10-14 |
常温下,0.1 mol·L-1CH3COONa溶液pH=11,下列表述正确的是( )
| A.c(Na+)=c(CH3COO—) |
| B.c(CH3COO—)+c(CH3COOH)=0.1 mol·L-1 |
| C.由水电离出来的c(OH—)=1.0×10-11 mol·L-1 |
| D.往该溶液中加入0.05 mol·L-1的CH3COONa,pH值变大 |
实验测得常温下0.1mol/L某一元酸HA溶液的pH≠1,0.1mol/L某一元碱BOH溶液里 。将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )
。将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )
A.c (A-)>c (B+)>c (H+)>c (OH-)
B.c (B+)=c (A-)>c (H+)=c (OH-)
C.c (OH-)- c (H+)=c(HA)
D.c (B+)+ c (H+)="c" (A-)+c (OH-) + c(HA)
0.02mol·L-1的HCN溶液与0.02mol·L-1NaCN溶液等体积混合,已知混合溶液中:
c(CN-)﹤c(Na+),则下列关系中,正确的是 ( )
| A.c(Na+)﹥c(CN-)﹥c(H+)﹥c(OH-) | B.c(HCN)+c(CN-)=0.04mol·L-1 |
| C.c(Na+)+c(H+)=c(CN-)+c(OH-) | D.c(CN-)﹥c(HCN) |
以酚酞为指示剂,用0.1000mol•L ﹣ 1的NaOH溶液滴定20.00mL未知浓度的二元酸H 2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积V NaOH的变化关系如图所示。[比如A 2 ﹣的分布系数:δ(A 2 ﹣) ]
下列叙述正确的是( )

A.曲线①代表δ(H 2A),曲线②代表δ(HA ﹣)
B.H 2A溶液的浓度为0.2000mol•L ﹣ 1
C.HA ﹣的电离常数K a=1.0×10 ﹣ 2
D.滴定终点时,溶液中c(Na +)<2c(A 2 ﹣)+c(HA ﹣)
对滴有酚酞试液的下列溶液,操作后颜色变深的是
| A.明矾溶液加热 |
| B.CH3COONa溶液加热 |
| C.氨水中加入少量NH4Cl固体 |
| D.小苏打溶液中加入少量NaCl固体 |
下列属于水解方程式的是( )
A.CH3COO- + H2O CH3COOH + OH- CH3COOH + OH- |
B.NH4+ + H2O NH4OH + H+ NH4OH + H+ |
C.CH3COOH + H2O CH3COO—+ H3O+ CH3COO—+ H3O+ |
D.NaCl + H2O NaOH + HCl NaOH + HCl |
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
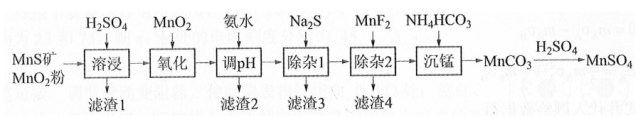
相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
| 金属离子 |
|
|
|
|
|
|
|
| 开始沉淀的pH |
8.1 |
6.3 |
1.5 |
3.4 |
8.9 |
6.2 |
6.9 |
| 沉淀完全的pH |
10.1 |
8.3 |
2.8 |
4.7 |
10.9 |
8.2 |
8.9 |
(1)"滤渣1"含有S和________;写出"溶浸"中二氧化锰与硫化锰反应的化学方程式________。
(2)"氧化"中添加适量的 的作用是将________。
(3)"调pH"除铁和铝,溶液的pH范围应调节为________~6之间。
(4)"除杂1"的目的是除去 和 , "滤渣3"的主要成分是________。
(5)"除杂2"的目的是生成 沉淀除去 。若溶液酸度过高, 沉淀不完全,原因是________。
(6)写出"沉锰"的离子方程式________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当 时, z=________。
代表阿伏伽德罗常数的值,下列说法正确的是()
| A. | 常温常压下, 中所含P-P键数目为 |
B. | 溶液中所含 的数目为 |
| C. | 标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为 |
D. | 密闭容器中, 和 催化反应后分子总数为 |
化学在生活中有着广泛的应用,下列对应关系错误的是( )
| |
化学性质 |
实际应用 |
| A |
和小苏打反应 |
泡沫灭火器灭火 |
| B |
铁比铜金属性强 |
腐蚀Cu刻制印刷电路板 |
| C |
次氯酸盐具有氧化性 |
漂白粉漂白织物 |
| D |
HF与 反应 |
氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A |
B. | B |
C. | C |
D. | D |
化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
| 选项 |
现象或事实 |
解释或对应的方程式 |
| A |
用热的纯碱溶液洗去油污 |
CO32-+2H2O H2CO3+2OH- H2CO3+2OH-溶液呈碱性 |
| B |
酸雨样品在空气中放置pH减小 |
亚硫酸被氧化为硫酸2SO32-+O2=2SO42- |
| C |
“84”消毒液具有漂白性 |
2ClO-+CO2+H2O=2HClO+CO32- |
| D |
用加热法除去NaOH固体中混有的NH4Cl固体 |
NH4Cl NH3↑+HCl↑ NH3↑+HCl↑ |
常温下,0.1mol/L的氯化铵溶液中,离子浓度最大的是
| A.Cl- | B.OH- | C.H+ | D.NH4+ |
试题篮
()