常温下的下列溶液,有关说法正确的是
A.某酸H2A的钠盐NaHA溶液中:c(A2-) < c(H2A),则该溶液的pH>7
B.1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0
C.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
D.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同
常温下,0.2 mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是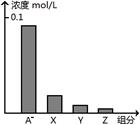
| A.HA为强酸 |
| B.该混合液pH=7 |
| C.图中X表示HA,Y表示OH-,Z表示H+ |
| D.该混合溶液中:c(A-)+c(Y)=c(Na+) |
(1)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的

①c电极为_____,d电极上的电极反应式为______________________。
②图乙是用惰性电极电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为________________。若a电极产生56mL(标准状况)气体,则所得溶液的pH=_______________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入____________(选填字母序号)
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |
25℃时,将V1 ml 0.1 mol /L NaOH溶液和V2 ml 0.1 mol /L的CH3COOH溶液充分混合,若混合后溶液呈中性,则该混合溶液中有关粒子的浓度应满足的关系是
A. |
B. |
C. |
D. |
回答下列问题:
(1)某溶液可能呈酸性或碱性,此外还有Na+、SO42-和Cl-,且测得此三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为 。
(2)在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是 。
(3)液氨类似于水的电离,试写出液氨的电离方程式 。
(4)某二元酸(H2A)在水中的电离方程式是:H2A=H++HA- , HA- H++A2-,用离子方程式表示Na2A溶液呈酸碱性的原因:
H++A2-,用离子方程式表示Na2A溶液呈酸碱性的原因:
下列说法正确的是( )
| A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B.25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸>VNaOH |
| C.在蒸馏水中滴加浓H2SO4,KW不变 |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中正确的是(忽略混合前后溶液体积变化)( )
| A.溶液的pH值:①>③>② |
| B.水电离出的c(OH-):③>①=② |
| C.①和③等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.1mol/L |
| D.②和③等体积混合后的溶液:c(Na+)=c(CH3COOH)+c(CH3COO-) |
下列说法正确的是( )
| A.FeCl3和NaHCO3的固体混合物,加热时有气体产生,加水溶解时有沉淀生成。 |
| B.25℃与60℃时,水的pH相等 |
| C.中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)不相等 |
| D.2SO2(g)+O2(g)= 2SO3(g)和 4SO2(g)+2O2(g)= 4SO3(g)的△H相等 |
pH=2的盐酸和pH=12的氨水等体积混合后,溶液中离子浓度大小顺序正确的是
| A.c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D.c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
下列说法中,正确的是( )
| A.0.1mol/L醋酸钙溶液中,c (Ca 2+)> c(CH3COO-)> c(OH-)> c(H+) |
| B.体积和pH 都相同的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少 |
| C.将nmolH2(g)、nmol I2(g)和2nmolH2(g)、2nmolI2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D.某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,该溶液的pH一定为14-a |
常温下浓度均为0.1 mol/L的四种盐溶液,其pH如下表所示,下列说法正确的是
| A.将等浓度的CH3COOH和HClO溶液,pH小的是HClO |
| B.Na2CO3和NaHCO3溶液中粒子种类不同 |
| C.溶液水的电离程度①>②>④>③ |
| D.NaHCO3溶液中,c(Na +)=c(CO32- )+c(HCO3- )+c(H2CO3) |
下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1CH3COONa 溶液,并分别放置在盛有水的烧杯中,
然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
(1)含酚酞的0.01 mol·L-1CH3COONa溶液显浅红色的原因为(用离子方程式表达)________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是______。
| A.水解反应为放热反应 |
| B.水解反应为吸热反应 |
| C.NH4NO3溶于水时放出热量 |
| D.NH4NO3溶于水时吸收热量 |
(3)向0.01 mol·L-1CH3COONa溶液中分别加入NaCl固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为___________、______、_________。(填“左”、“右”或“不移动”)
下列说法正确的是 ( )
| A.pH = 3的盐酸和pH = 11的氨水等体积混合 pH=7 |
| B.pH = 3的醋酸和pH = 11的氢氧化钡溶液等体积混合 pH < 7 |
| C.pH = 3的盐酸和pH = 11的氢氧化钡溶液等体积混合 pH >7 |
| D.取浓度相同的NaOH 和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为0.005mol·L-1 |
试题篮
()