某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA- HA-
H++HA- HA- H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-)(α表示弱电解质的电离程度),设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(1)c(H+)最大的是________,最小的是________。
(2)c(H2A)最大的是________,最小的是________。
(3)c(A2-)最大的是________,最小的是________。
常温下,取pH="2" 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)="0.01mol" /L
C.pH=3的NaHA水溶液中,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)
下列说法正确的是
| A.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
| B.一定量的(NH4)2SO4与NH3·H2O混合所得的酸性溶液中:c(NH)<2c(SO) |
| C.物质的量浓度均为0.01 mol·L-1的CH3COOH和CH3COONa的溶液等体积混合后溶液中c(CH3COOH)+c(CH3COO-)=0.02 mol·L-1 |
| D.物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中c(NH):①>②>③ |
在常温条件下,下列对醋酸的叙述中,不正确的是
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| B.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小 |
| C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后: c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
| D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14 |
已知Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是
| A.Al2S3、FeS和S | B.Fe(OH)3和Al(OH)3 |
| C.Fe2S3和Al(OH)3 | D.FeS、Al(OH)3和S |
Na2CO3溶液中含碳元素微粒有多种,常温下,这些微粒的物质的量分数与溶液pH的变化关系如图所示。下列说法正确的是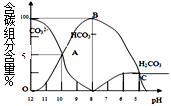
| A.在滴有酚酞的Na2CO3溶液中逐渐滴加盐酸至溶液恰好变为无色,得到NaHCO3溶液 |
| B.有CO2气体放出的范围是pH≤5 |
| C.HCO3-的电离平衡常数为1×10-4 |
| D.pH=11的Na2CO3溶液稀释到体积为原来的100倍后pH=9 |
某硫酸厂用以下几种方法处理SO2尾气。

(1)活性炭还原法
反应原理:恒温恒容2C (s)+2SO2(g) S2(g)+2CO2(g) 。
S2(g)+2CO2(g) 。
反应进行到不同时间测得各物质的浓度如图:
①第一次出现平衡的时间是第 min;
②0~20min反应速率表示为V(SO2)= ;
③30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是 ;40min时,平衡常数值为__________。
(2)亚硫酸钠吸牧法
①Na2SO3溶液吸收SO2的离子方程式为 ;
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
a.c(Na+)+c(H+) >c(SO32-)+c(HSO3-)+ c(OH-)
b.c(Na+) = c(SO32-) + c(HSO3-)+ C(H2SO3)
c.c(Na+)> c(SO32-)> c(OH-)>c(H+)
d.水电离出c(OH一)=l×l0-8 mol/L,
(3)电化学处理法
如图所示,Pt(1)电极的反应式为 ;碱性条件下,用Pt(2)电极排出的S2O42-溶液吸收NO2,使其转化为N2,同时有SO32-生成。若阳极转移电子6mol,则理论上处理NO2气体 mol。

常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
| A.实验进程中可用pH试纸测定溶液的pH |
| B.a点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) |
| C.c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
D.由a点到b点的过程中,溶液中 减小 减小 |
下列说法正确的是
| A.在pH等于2的醋酸溶液中加入少量0.01 mol•L﹣1的稀盐酸,溶液的pH会变小 |
| B.等物质的量浓度的碳酸钠溶液与碳酸氢钠溶液混合,混合溶液中c(CO32-) 一定小于c(HCO3-) |
| C.等浓度的CH3COOH和CH3COONa溶液按体积比2:1混合后的溶液中:2C(CH3COO-)+3c(OH-)=3c(H+)+C(CH3COOH) |
| D.常温下,在50.00mLpH=b的NaOH溶液中滴入11.11mL pH=a的盐酸时,溶液pH变为2,则此NaOH溶液的pH为11(已知a+b=13,混合后溶液体积为61.11mL) |
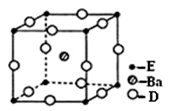
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32-离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
(4) D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。
(5)纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
常温下,向10 mL 0.1 mol·L-1的CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,所得滴定曲线如图所示。下列说法一定正确的是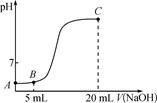
| A.A点的pH为1 |
| B.B点时:2c(H+) +c(CH3COOH)=2c(OH-)+c(CH3COO-) |
| C.在A→B之间:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.C点时:c(H+) +c(Na+) =c(OH-)+c(CH3COO-) |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.在0.1mol·L-1NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.在0.1mol·L-1CH3COOH中: c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) |
| C.0.2mol·L-1NaHCO3溶液与0.1mol·L-1KOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.0.2mol·L-1氨水与0.1mol·L-1HCl溶液等体积混合:c(Cl-)+c(H+)=c(NH3·H2O)+c(OH-) |
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol•L-1 NaHC2O4溶液中滴加0.01 mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2 mol•L-1 |
| B.V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L |
| D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-) |
25℃时,0.1 mol/L的HA溶液中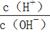 =1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是_________(填“强电解质”或“弱电解质”,下同),BOH是__________。
(2)HA的电离方程式是_______________________________________。
其中由水电离出的c(H+)=________mol/L
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_______(填字母)。
A.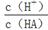 |
B.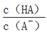 |
| C.c(H+)与c(OH-)的乘积 |
| D.c(OH-) |
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈 性,请用离子方程式解释其原因_____________,混合溶液中各离子浓度由大到小的顺序是 。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11。(混合溶液体积变化忽略不计),应加_________mL(保留到小数点后一位)
试题篮
()