(1)有下列物质①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤H2O ⑥熔融NaCl ⑦BaSO4属于弱电解质的是________________(填序号);
(2)常温下,0.1 mol•L-1NaHCO3溶液的pH大于8,则溶液中的Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________;NaHCO3水解的离子方程式为_____________;
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol•L-1) |
NaOH物质的量浓度(mol•L-1) |
混合溶液的pH |
| a |
0.1 |
0.1 |
pH=9 |
| b |
c |
0.2 |
pH=7 |
请回答:
①从a组情况分析,HA是强酸还是弱酸____________;
②b组情况表明,c_____0.2 (选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)_________c(Na+);(选填“>”、“<”或“=”)
③a组实验所得混合溶液中由水电离出的c(OH-)=_______mol•L-1。
(1)25℃时,浓度为0.1mol•L-1的6种溶液,①HCl ②CH3COOH ③Ba(OH)2 ④Na2CO3 ⑤KCl ⑥NH4Cl溶液pH由小到大的顺序为_____________(填写编号);
(2)25℃时,醋酸的电离常数Ka=1.7×10-5 mol•L-1,则该温度下CH3COONa的水解平衡常数Kh="_____" mol•L-1 (保留到小数点后一位)
(3)25℃时,pH=3的醋酸和pH=11的NaOH溶液等体积混合,溶液呈_________(“酸性”、“中性”、“碱性”),请写出溶液中的电荷守恒式:_______________。
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种。已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,有回答下列问题:
(1)X是_______,Z是_______;
(2)Z、W两溶液中水的电离程度由大到小的顺序为 _______(用化学式表示);
(3)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
(1)FeCl3的水溶液显________(“酸”、“中”、“碱”)性,原因是(用离子方程式表示):______;
(2)实验室配制FeCl3的溶液时,常将固体FeCl3先溶于_______中,然后再用蒸馏水稀释到所需的浓度。
(3)把FeCl3溶液蒸干、灼烧,最后得到的主要产物是____________
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释)________________________________;
(5)Al2S3为什么不能用Na2S溶液和AlCl3溶液制备(用离子方程式解释)__________________;
25℃,浓度都是1mol•L-1的四种正盐溶液,其pH情况如下:
| AX |
BX |
AY |
BY |
| pH=7,c(X-)=1mol/L |
pH=4 |
|
pH=6 |
(1)AY溶液pH__________7(填“>”、“<”或“=”);
(2)将等浓度的HX、HY稀释相同的倍数,溶液的pH变化幅度:HX__________HY;若将等体积、等 pH的AOH、BOH溶液在稀释时pH均下降2,则加水量:AOH________BOH(均填“>”、“<”或“=”);
(3)在BX溶液中:c(B+)+c(H+)-c(OH-)=_______mol/L;
在AY溶液中:c(A+)-c(Y-)=_________(用一项表示)=_________(用两项表示);
(4)A2Z的水解方程式是_________;_________。
关于下列溶液的一些说法中,完全正确的是
室温下,①pH=4;FeCl3溶液;②pH=10;Na2CO3溶液;③pH=2;HCl溶液;④pH="3" CH3COOH溶液;⑤pH=11NaOH溶液;⑥pH=3NH4Cl溶液
| A.水的电离程度:①=②、③<④、⑤=⑥ |
| B.④、⑤溶液等体积混合后所得溶液中水的电离程度大于纯水的电离程度 |
| C.⑤、⑥溶液等体积混合后所得溶液中离子浓度顺序是c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.②溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) |
硫及其化合物有广泛应用。
(1)硫酸生产过程中涉及以下反应。已知25℃、101KPa时:
①2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
则SO2催化氧化为SO3(g)的热化学方程式为______________________。
(2)对于SO3催化氧化反应:2SO2(g)+O2(g)⇌2SO3(g).
①甲图是SO2催化氧化反应时SO2(g)和SO3(g)的浓度随时间的变化情况.反应从开始到达到平衡时,用O2表示的平均反应速率为______________________。
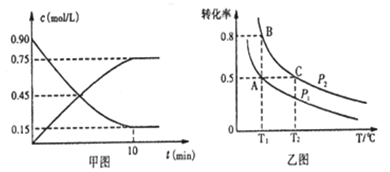
②在一容积可变的密闭容器中充入20molSO2(g)和l0molO2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示.则P1与P2的大小关系是P1____________P2(填>、=或<);A、B、C 三点的平衡常数大小关系是______(用KA、KB、KC和>、=、<表示)。理由是____________。
(3)工业生成硫酸过程中,通常用氨水吸收尾气。
①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为____________。所得溶液中c(H+)-c(OH-)= ______(填序号)。
A.c(SO32-)-c(H2SO3) B.c(HSO3-)+c(SO32-)-c(NH4+)
C.c(SO32-)+c(NH3•H2O)-c(H2SO3) D.c(HSO3-)+2c(SO32-)-c(NH4+)
②已知:在25℃时NH3•H2O、H2SO3电离平衡常数如下表,则上述所得溶液中,各离子浓度由大到小的顺序为___________________________。
| |
NH3•H2O |
H2SO3 |
|
| 电离平衡常数为 (mol•L-1) |
1.7×10-5 |
Ka1 |
Ka2 |
| 1.54×10-2 |
1.02×10-7 |
常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是:
A.某HCl溶液的pH值为2,则溶液中由水电离的c(H+)=10-2mol•L-1
B.0.1 mol•L-1的KHA溶液,其pH=10, c(K+)>c(A2-)>c(HA-)>c(OH-)
C.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D.将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后溶液pH>7,则反应后的混合液:c(HA)>C(Na+)>c(A-)
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
(1)同温度下,等pH值的a.NaHCO3 b.NaCN c.Na2CO3溶液的物质的量浓度由大到小的顺序为_____________(填序号)。
(2)25℃时,将20mL 0.1mol·L-1 CH3COOH溶液和20mL 0.1mol·L-1 HSCN溶液分别与20mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
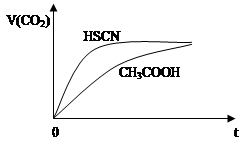
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:______________________。
反应结束后所得两溶液中,c(SCN—) c(CH3COO—)(填“>”、“<”或“=”)
(3)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是______________(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数
下列溶液中有关物质的浓度关系正确的是
| A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)> c[(NH4)2SO4]> c(NH4Cl) |
| B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数(25 ℃) |
K1=1.77×10-4 |
K1=4.9×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是( )
A.2CN-+H2O+CO2 → 2HCN+CO32-
B.2HCOOH+CO32-→ 2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液pH前者小于后者
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是 ( )
| A.pH=5.2的CH3COOH与CH3COONa混合溶液中,c(Na+)<c(CH3COO-) |
| B.在滴加酚酞溶液的氨水中,加入NH4Cl溶液恰好无色,则此时溶液的pH﹤7 |
| C.Na2CO3溶液中,c(OH-)-c(H+)= c(HCO3-)+2 c(H2CO3) |
| D.pH=2的一元酸溶液与pH=12的NaOH溶液等体积混合,则溶液的pH一定不大于7 |
混合下列各组物质使之充分反应,加热蒸干产物并高温下灼烧至质量不变,最终残留固体为纯净物的是( )
| A.向CuSO4溶液中加入适量铁粉 |
| B.等物质的量浓度、等体积的FeCl3与KI溶液混合 |
| C.物质的量之比为2:1的NaHCO3与Na2O2溶于水 |
| D.在Na2SiO3溶液中通入过量CO2气体 |
2015年8月12日晚,天津滨海新区某公司仓库发生爆炸,事发仓库里存放了大量的硝酸铵、氰化钠(NaCN)、金属钠等危险化学品。回答下列问题:
(1)NaCN的电子式为: 。
(2)金属钠属于危化品中的易燃固体,其着火时不能用水灭火,请用化学方程式解释其原因:_____________________________。
(3)氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡。氰化钠易溶于水,水溶液呈强碱性。氰化钠泄露可用双氧水或硫代硫酸钠中和。
①用离子方程式表示氰化钠水溶液呈强碱性的原因: 。
②用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式_____________________________;
③用硫代硫酸钠中和的离子方程式为CN—+S2O32—→A+SO32—(已配平),A为 (填化学式)。
(4)CN— 中C元素显+2价,N元素显﹣3价,则非金属性N_______C(填<、=或>),请用简单的实验方法证明(要求说明简单操作、现象和结论): 。
(5)0.4mol/L 的NaCN和0.2mol/L的HCl等体积混合,溶液显碱性,其溶液中离子浓度大小排列顺序是
室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是
| A.向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
| B.向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) |
| C.向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c]HSO3-)+c(H2SO3)] |
| D.向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
试题篮
()