下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择,并填空
A. M>N B. M<N C. M=N D. 无法比较
(1)相同温度下,1L 1 mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5 mol/L NH4Cl溶液中NH4+的个数: ;
(2)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
(3)室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7,原酸溶液和原碱溶液的物质的量浓度: ;
(4)用惰性电极分别电解NaCl溶液和CuSO4溶液,一段时间后,则两个电解池中前者阴极附近溶液的PH与后者阳极附近溶液的PH大小关系是: ;
(5)同条件下,一堆钢管单独露天堆放,另一堆钢管与铜管露天堆放在一起,则两堆钢管腐蚀的速率: ;
(6)PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是: 。
已知: I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O,加入CuO,调至pH=4,使溶 液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O。
(2)在空气中直接加热CuCl2·2H2O得不到纯的无水CuCl2,原因是 (用化学方程式表示)。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(发生反应:2Cu2++4I- 2CuI↓+I2)。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
2CuI↓+I2)。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
① 可选用 作滴定指示剂,滴定终点的现象是 。
② 该试样中CuCl2·2H2O的质量分数为 。
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50 ℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为__________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度____________(填“大于”或“小于”)NaHCO3。
(2)丙同学认为甲、乙的判断都不充分。丙认为,只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则__________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(3) 查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)的判断是错误的,理由是___________________________。
物质的量浓度相同时,下列既能跟NaOH溶液反应,又能跟盐酸反应的溶液中,pH最大的是
| A.Na2CO3溶液 | B.NH4HCO3溶液 | C.NaHSO4溶液 | D.NaHSO3溶液 |
有4种混合溶液,分别由等体积0.1 mol/L的两种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3
下列各项排序正确的是
| A.pH:②>③>④>① | B.c(CH3COO-):②>④>③>① |
| C.溶液中c(H+):①>③>②>④ | D.c(CH3COOH):①>④>③>② |
下列溶液中各离子的浓度关系正确的是
| A.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)="0.1" mol·L-1 |
| B.25℃时,等物质的量浓度的各溶液pH关系为: pH(Na2CO3)>pH(C6H5ONa)>pH(NaHCO3)>pH(CH3COONa) |
| C.25℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) |
| D.将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题。

工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g) 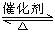 2SO3(g) + Q
2SO3(g) + Q
某温度下,测得SO2(g)的平衡转化率( )与体系总压强( p )的关系如上图所示。
)与体系总压强( p )的关系如上图所示。
28.a、b两点对应的平衡常数K(a) K(b) (填“>”、 “<”或“=”,下同),SO3浓度c(a) c(b)。c点时,反应速率υ(正) υ(逆)。
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
||
| SO2 |
O2 |
SO2 |
O2 |
||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
29.实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为 ,温度T1大于T2的理由是 。
30.制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
①0.1 mol/L的NaHSO3溶液中c(H+) >c(OH-),用水解和电离理论的角度解释其原因 ,若往溶液中加入氨水至中性,则c(Na+) c(HSO3-)+c(SO32-)+c(H2SO3)(填“>”、 “﹤”或 “=”)。
②往0.1 mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+) :c(SO32-)的比值 (填“变大”、“变小”或“保持不变”)。
常温下有下列四种溶液:
| |
① |
② |
③ |
④ |
| 溶液 |
pH=4的NH4Cl |
pH=4的盐酸 |
0.1 mol·L-1的醋酸 |
0.1 mol·L-1的NaOH |
已知该温度下醋酸的电离平稀常数Ka=1.8×10-5。请回答下列问题:
(1)用④的标准液滴定③宜选用 (填“石蕊”、“酚酞”或“甲基橙”)作为指示剂;①②溶液中由水电离出的c(H+)之比为 。
(2)将②③④三种溶液分别加水稀释10倍,pH变化最小的是 (用序号表示),用pH试纸测定溶液pH的操作方法是 。
(3)都是0.1mol/L的①NH4Cl.②NH4HCO3.③CH3COONH4.④NH4HSO4的溶液中NH4+离子浓度大小顺序为 。(用序号填写)
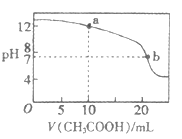
(4)取适量溶液③滴定20 mL溶液④,滴定曲线如右图所示,则a点时溶液中各离子浓度的大小关系为 。若b点时消耗③的体积为V mL,则V 20(填“>”.“<”或“=”)。
下列溶液中有关粒子的物质的量浓度关系正确的是
A.氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO)
B.25℃时,pH=12的NaOH溶液与pH=12的氨水:c (Na+ ) = c(NH4+ )
C.pH=4的0.1 mol·L-1的NaHA溶液中:c (HA-) > c (H+ ) > c (H2A) > c (A2- )
D.在K2CO3溶液中:c (CO32- ) + c (OH- ) = c (HCO3- ) + c( H+ )
常温下,下列有关醋酸溶液的叙述中不正确的是( )
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO—) |
| B.浓度均为0.1mol/L的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO—)- c(CH3COOH)=2[c(H+)- c(OH—)] |
C.将pH=a的醋酸稀释为pH=a+1的过程中,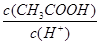 不变 不变 |
| D.0.2mol/L的CH3COOH溶液中c(H+)与0.1mol/LCH3COOH溶液中c(H+)的比值小于2 |
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50 ℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为:该溶液pH升高的原因是HCO的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则________(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是_____________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
c.HCO3-的电离程度大于HCO3-的水解程度
将20 mL 0.1 mol·L-1的氨水与10 mL 0.1 mol·L-1的盐酸混合,所得到的溶液中离子浓度的关系错误的是( )
| A.c(NH4+)+c(H+)=c(OH-)+c(Cl-) |
| B.c(NH4+)+c(NH3·H2O)=2c(Cl-) |
| C.2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O) |
| D.c(H+)=c(NH3·H2O)+c(OH-) |
下列叙述正确的是
| A.NaHCO3溶液中存在: c(OH-) =c(H+)+c(H2CO3) |
| B.某二元弱酸强碱盐NaHA溶液中存在:c(Na+)+c(H+)=c(A2-)+c(HA-)+c(OH-) |
| C.CH3COONa和NaCl混合溶液中存在:c(Na+)=c(CH3COO-)+c(Cl-) |
| D.常温下,10mL 0.02mol·L-1 HCl溶液与10mL 0.01mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
国家环境保护总局网公布了”141种高污染、高环境风险”的产品名录,包括43号氰化钠、46号氢氰酸、55号高氯酸铵、57号硫化钠等。下列说法不正确的是
A.已知常温下0.1  NaCN溶液的pH=12,则已水解的 NaCN溶液的pH=12,则已水解的 约占总数的10% 约占总数的10% |
B.已知25 ℃时 溶液显碱性,则25 ℃时的电离常数K 溶液显碱性,则25 ℃时的电离常数K K(HCN) K(HCN) |
C. 溶液中,c 溶液中,c c c c c c c |
D.欲使0.1   溶液中 溶液中 更接近2,可加入适量KOH 更接近2,可加入适量KOH |
试题篮
()