常温下,将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合后,溶液pH>7,以下关系式错误的是
A.电荷守恒:c(Na+)+c(H+)= c(A-)+c(Cl-)+c(OH-)
B.物料守恒:c(HA)+c(A-)=0.1mol/L
C.质子守恒:c(HA)+c(H+)= c(A-)+c(OH-)
D.物料守恒:c(Na+)= c(A-)+ c(HA)
下列说法中,正确的是
| A.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| B.取相同浓度的NaCl溶液和NaClO溶液,NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度 |
| C.某盐的溶液呈酸性,该盐一定发生了水解反应 |
| D.pH相同的盐酸和氯化铵溶液中由水电离出的c(H+)相同 |
关于小苏打水溶液的表述正确的是
| A.c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3) |
| B.c(Na+)+c(H+) = c(HCO3-) + c(CO32-) + c(OH-) |
| C.HCO3-的电离程度大于HCO3-的水解程度 |
| D.存在的电离有:NaHCO3 = Na++ HCO3-,HCO3- = H++ CO32- |
下列叙述中正确的是
| A.向体积为Va的0.02 mol·L-1 CH3COOH溶液中加入体积为Vb的0.02 mol·L-1 NaOH溶液,Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(Na+) |
| B.将0.2 mol·L-1的盐酸与0.1 mol·L-1的KAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-) |
| C.pH=5的HCOOH溶液和pH=5的NH4NO3溶液中,c(H+)不相等 |
| D.25 ℃时,pH=4,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4﹣、HPO42﹣、和PO43﹣四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为 .当pH=7时,溶液中主要存在的阴离子(OH﹣离子除外)是 .
(3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是 .
(4)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是 。
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收.请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收.请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是 .
| A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态 |
| B.保持温度和容器体积不变,充入2mol N2,化学反应速率加快 |
| C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大 |
| D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大 |
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| SO2 |
O2 |
SO2 |
O2 |
|||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
6 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为 ,表中y= .
②T1 T2,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为 .
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3.现有常温下0.1mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:
①该溶液中c(Na+)与c(OH﹣)之比为 .
②该溶液中c(OH﹣)=c(H+)+ + (用溶液中所含微粒的浓度表示).
③当向该溶液中加入少量NaOH固体时,c(SO32﹣) ,c(Na+) .(选填“增大”、“减小”或“不变”)
下列有关电解质溶液中粒子浓度关系正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42﹣)+c(OH﹣) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl﹣)=c(I﹣) |
| C.CO2的水溶液:c(H+)>c(HCO3﹣)=2c(CO32﹣) |
| D.含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4)] |
下列溶液中有关微粒的物质的量浓度关系正确的是
| A.3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) |
| C.常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7 mol·L-1 |
| D.物质的量浓度之比为1∶2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
18.下列各溶液中,相关微粒物质的量浓度关系不正确的是
| A.0.1 mol·L-1NH3•H2O溶液中: c (NH4+)<c (OH-) |
| B.常温时,将等体积的盐酸和氨水混合后pH=7,则c(NH4+)=c(Cl-) |
| C.0.1 mol·L-1Na2CO3溶液中:c(HCO3-)+c(CO3-)+c(H2CO3)="0.1" mol·L-1 |
| D.浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4、NH4HSO4溶液,c(NH4+)大小顺序:CH3COONH4 >NH4Cl>NH4HSO4 |
25℃时,下列各溶液中有关微粒物质的量浓度关系正确的是
| A.0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合:c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-) =c(H+) |
25℃时,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示。下列说法正确的是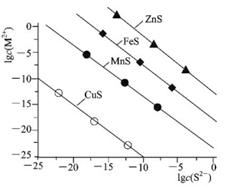
| A.Ksp(CuS)约为l×10-20 |
| B.向Cu2+浓度为10-5mol•L-1废水中加入ZnS粉末,会有CuS沉淀析出 |
| C.向l00mL浓度均为10-5mol•L-1 Zn2+、Fe2+、Mn2+的混合溶液中逐滴加入10-4mol•L-1 Na2S溶液,Zn2+先沉淀 |
| D.Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+) |
25℃时,将氨水与氯化铵溶液混合得到 c(NH3·H2O)+c(NH4+) = 0.1mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述一定正确的是
| A.W点表示溶液中:c(NH4+) +c(H+) = c(Cl-)+c(OH-) |
| B.pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1mol·L-1 |
| C.pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+) |
| D.向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-) >c(NH4+) >c(H+) |
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3。下列有关叙述正确的是
| A.酸性由强至弱:HX>HY>H2CO3 |
| B.结合H+的能力:Y->CO32->X->HCO3- |
| C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D.NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是: (填字母序号)。
②实验前,首先要准确配制一定物质的量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除托盘天平、玻璃棒、烧杯、胶头滴管、量筒外,还需要 (填仪器名称)。
③该小组拟在同浓度的FeSO4溶液中,探究酸性KMnO4溶液浓度对Fe2+被氧化时反应速率的影响。限选试剂与仪器:0.10mol∙L-1FeSO4、0.02mol∙L-1酸性KMnO4、蒸馏水、锥形瓶、试管、胶头滴管、量筒、秒表。参照下表格式,完成实验表格(列出所选试剂体积和数据;数据用字母表示)。
 物理量 物理量实验序号 |
V[0.10mol∙L-1FeSO4] /mL |
|
|
KMnO4溶液褪色所需时间t/s |
| 1 |
a |
|
|
t1 |
| 2 |
a |
|
|
t2 |
(2)常温下,探究小组乙将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如右图所示。
①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)= 。
②b点处溶液中c (Cl-) c (NH4+)(填“>”、“<”或“=”)。
③取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置。写出实验现象并用必要的文字和相关离子方程式给予解释: 。
④d点所示溶液中离子浓度由大到小的排序是 。
(12分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验 编号 |
HA物质的量 浓度(mol·L-1) |
NaOH物质的量 浓度(mol·L-1) |
混合溶 液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组实验分析,HA是________(填“强酸”或“弱酸”)。
(2)②组实验表明,c________0.2(填“大于”、“小于”或“等于”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是__________________。
(3)从③组实验结果分析,说明HA的电离程度______(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是_______________________。
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)- c(HA)=_________mol/L
试题篮
()