对下列各溶液中,微粒的物质的量浓度关系表述正确的是
| A.0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.在25℃100 mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O) |
下列说法正确的是
| A.在Na2CO3和NaHCO3两溶液中,离子种类相同 |
| B.在等体积、等物质的量浓度的Na2CO3和NaHCO3两溶液中,阳离子总数相等 |
| C.在NaHCO3和Na2CO3混合溶液中一定有:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
| D.在NaHCO3和Na2CO3混合溶液中一定有:2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3 )] |
(每空2分,共12分)
I、(1)已知1 g H2S气体完全燃烧,生成液态水和二氧化硫气体,放出17.24 kJ热量,请写出H2S气体燃烧热的热化学方程式:
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。反应的热化学方程式为 。
II、已知常温下在NaHSO3溶液中c(H2SO3 )<c(SO32-) 且H2SO3的电离平衡常数为: K1=1.5×10-2 K2=1.1×10-7 ;氨水的电离平衡常数为K=1.8×10-2;
(1)则等物质的量浓度的下列五种溶液:①NH3·H2O ②KHSO3③KHCO3 溶液中水的电离程度由大到小排列顺序为
(2)0.1 mol·L-1的NaHSO3溶液中C(H+) C(OH-)(“>”、“<”或“=”):
Ⅲ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)在25 ℃下,向浓度均为0.1 mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol/L时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol/L。此时所得沉淀中________(填“含有”或“不含有”)Al(OH)3。
常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是
A.H2A为二元强酸
B.pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B)
D.Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+)
(7分)(1)常温下,已知0.1 mol·L—1一元酸HA溶液中c(OH-)/c(H+)=1×10—8,则溶液的pH=_____________。
①pH=3的HA与pH=l1的NaOH溶液等体积混合;反应的离子方程式为______________;混合溶液中,各离子的物质的量浓度大小关系是____________;
②0.2 mol·L—1HA溶液与0.1 mol·L—1NaOH溶液等体积混合后所得溶液中(溶液体积变化忽略不计):c(H+)+ c(HA)— c(OH-)=" ____________" mol·L—1。
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=___________。
①该温度下(t℃),将100mL0.1 mol·L—1的稀H2SO4与100mL0.4 mol·L—1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___________;
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是_______________。
(17分)二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)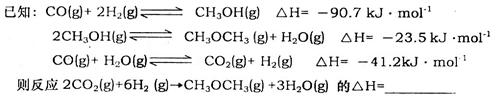
(2)已知在一定温度下,以下三个反应的平衡常数为k1、k2、k3: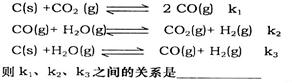
(3)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解100mL 1mo1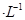 的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的负极反应式为_____________。
②电解后溶液的PH=_________________________
(4)工业合成氨的反应为: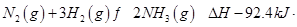 mol-1
mol-1
已知合成氨反应在某温度下2L的密闭绝热容器中进行,测得数据如下表: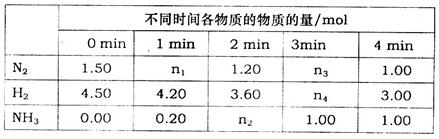
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向_______(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
(5)常温下,将0.2mol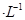 HCOOH和0.1mol
HCOOH和0.1mol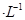 NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。该溶液中[HCOOH]-[OH-]+[H+]=______mol
NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。该溶液中[HCOOH]-[OH-]+[H+]=______mol
下列说法中正确的是
| A.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 |
| B.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:ClO-+CO2+ H2O =HClO+HCO3- |
| C.一定温度下,1L0.5mol·L-1NH4Cl溶液中与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 |
| D.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+可能大量共存 |
(Ⅰ)水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将100℃下的pH=8的Ba(OH)2溶液与100℃下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。 (Ⅱ)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(Ⅱ)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
(3)若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(4)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(5)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系是c(NH4+) c(Cl-)。
(10分)神舟十号飞船是中国“神舟”号系列飞船之一,它是中国第五艘搭载太空人的飞船。神舟十号飞船发射成功后,将与2011年发射升空的天宫一号目标飞行器进行交会对接,开展相关空间科学试验。火箭推进器是成功发射的重要因素,事实上,推进器的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为:S+3C+2KNO3=K2S+N2↑+3CO2↑。
①K2S的电子式为 。
②取黑火药爆炸后的残留固体,加水溶解过滤,得到滤液。写出检验此溶液中是否含有K+的实验操作方法 。
(2)20世纪60年代,火箭使用的是液体推进剂,常用的氧化剂有四氧化二氮、液氧等,可燃物有肼(N2H4)、液氢等。
①肼(N2 H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
②一种与N2 H4电子数相等的绿色氧化剂,能将油画表面黑色的PbS氧化成白色的PbSO4,使油画变白、翻新,化学方程式为: 。
(3)以上的火箭推进剂一般含有氮元素,含氮化合物种类丰富。有一含氮化合物,具有很强的爆炸性,86g该化合物爆炸分解会生成标况下N267. 2L和另一种气体单质H2。写出其爆炸的化学方程式 。
下列有关溶液中微粒的物质的量浓度关系正确的是
| A.1L0.1mol/L(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| B.25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| C.25℃时,BaCO3饱和溶液(Ksp=8.1×10-9):c(Ba2+)=c(CO32-)>c(H+)=c(OH-) |
| D.1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是
| A.溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B.若溶液中部分粒子间满足:c(CH3COO-)=c(Na+)则该溶液一定呈中性 |
| C.若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
(1)已知:Fe(s)+ O2(g)=FeO(s) △H=-272.0kJ•mol-1
O2(g)=FeO(s) △H=-272.0kJ•mol-1
2Al(s)+ O2(g)=Al2O3(s) △H=-1675.7kJ•mol-1
O2(g)=Al2O3(s) △H=-1675.7kJ•mol-1
Al和FeO发生铝热反应的热化学方程式是 。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(S)+4H2(g) Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)。
Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
常温下,下列说法不正确的是
| A.0.1 mol/L的Na2SO3溶液中粒子浓度关系:c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+) |
| B.将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液pH都减小 |
| C.把等体积的1×10-5 mol/L的硫酸与4×10-5 mol/L的NaOH溶液相混合,混合液的pH值与5×10-6 mol/L的Ba(OH)2溶液的pH值相同 |
| D.0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
下列溶液中微粒的浓度关于不正确的是
| A.NaClO溶液中:c(Na+)= c(ClO-)+ c(HClO) |
| B.等体积、等物质的量浓度的NaX和弱酸HX混合,所得溶液中:c(Na+)> C(X-)> c(H+)> c(OH-) |
| C.将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(NH4+)>c(Cl-)>c(NH3·H2O)> c(OH-)>c(H+) |
| D.将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(Na+)+c(H+)=" 2" c(S2-)+c(HS-)+c(OH-) |
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 ( L )+2N2O4 (L )=2CO2 (g)+3N2(g)+4H2O(g) (Ⅰ)
(1)该反应(Ⅰ)中还原剂是__________。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
一定温度下,反应(Ⅱ)的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________.
若在相同温度下,上述反应改在体积为3L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应4s后N2O4的物质的量为0.9mol,则0~4s内的平均反应速率v(NO2)=_________________。
(3)25℃时,将1mol NH4NO3溶于水,溶液显酸性,原因是_____(用离子方程式表示)。向该溶液滴加50mL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将_______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为____mol·L-1。(NH3·H2O的电离平衡常数K=2×10-5 mol·L-1)
试题篮
()