常温下,下列有关叙述正确的是
| A.在0.1mol·L-1Na2C2O4溶液中:2c(Na+)=c(C2O42-)+c(HC2O4—)+c(H2C2O4) |
| B.向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液:c((CH3COO—)>c(Na+)>c(OH-)>c(H+) |
| C.浓度均为0. 1 mol·L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+) =" 2c" (CO32-) + c(OH-) + c(HCO3-) |
| D.浓度均为0. 1 mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合c(SO42-) =c(Na+)>c(NH4+)>c(H+)>c(OH-) |
CO2溶于水生成碳酸。已知下列数据:
现有常温下1 mol· L-1的(NH4)2CO3溶液,已知NH4+的水解平衡常数 第一步水解的平衡常数
第一步水解的平衡常数 。下列说法正确的是
。下列说法正确的是
A.由数据可判断该溶液呈酸性
25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
| A.溶液的pH=5时,硫元素的主要存在形式为HSO3- |
| B.当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-) |
C.向pH=8的上述溶液中滴加少量澄清石灰水, 的值增大 的值增大 |
| D.向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小 |
(1)室温下,如果将0.1molCH3COONa和0.05molHCl全部溶于水,形成混合溶液(假设无损失), 和 两种粒子的物质的量之和等于0.1mol。
(2)已知某溶液中只有Na+、CH3COO-、H+、OH-四种离子。某同学推测该溶液中离子浓度可能有如下四种关系:
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(Na+)>c(CH3COO-)>c(H+) >c(OH-)
C.c(Na+)>c(OH-)> c(CH3COO-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+) >c(OH-)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小关系中正确的是(填序号) ;
②若上述关系中D是正确的,则溶液中溶质的化学式是 ;
③若该溶液由体积相等的醋酸与NaOH溶液混合而成,且溶液恰好呈中性,则混合前c(CH3COOH)(填“>”“<”“=”,下同) c(NaOH),混合后c(CH3COO-)与c(Na+)的关系是c(CH3COO-) c(Na+)。
(3)25℃时,向0.1mol/L的醋酸溶液中加入少量的醋酸钠固体,当固体溶解后,测得溶液的pH增大,主要原因是 (填序号)
A.醋酸与醋酸钠发生反应
B.醋酸钠溶液水解显碱性,增加了c(OH-)
C.醋酸钠溶于水电离出醋酸根离子,抑制了醋酸的电离,使c(OH-)减小。
已知:NH2COO-+2H2O HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
| A.无法判断T1和T2的大小关系 |
| B.T1℃时,第6min反应物转化率为6.25% |
| C.T2℃时,0~6min ν(NH2COO-)=0.3mol·L-1·min-1 |
| D.往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小 |
(本题共14分)火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害。对烟气中CO2、CO、SO2等物质进行回收利用意义重大。
(1)“湿式吸收法”利用吸收剂与烟气中的SO2发生反应从而脱硫,其中“钠碱法”用NaOH溶液作吸收剂,向100mL2mol·L-1的NaOH溶液中通入标准状况下4.48LSO2气体,反应后测得溶液pH<7.则溶液中下列各离子浓度关系正确的是 (填字母序号).
a.c(HSO3-)>c(SO32-)>c(H2SO3)
b.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
d.c(H+)= c(SO32-)- c(H2SO3)+c(OH-)
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示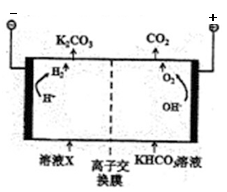
①在阳极区发生的反应中的非氧化还原反应的离子方程式为 .
②简述CO32-在阴极区再生的原理 .
(3)下表中列出了25℃、l0l kPa时一些物质的燃烧热数据:
已知键能:C—H键:413.4kJ.mol-l. H—H键:436.0 kJ·mol-1,请计算:
①2CH4(g)=C2H2(g)+3H2(g) △H=
②C2H2中—C≡C—的键能为 kJ·mol-l
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。负极反应式为 .为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,为此电池工作时必须有部分A物质参加循环,则A物质的化学式是 .
下列说法正确的是
| A.常温下,0.1 mol/L的下列溶液①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4⑤(NH4)2SO4中,c(NH4+)由大到小的顺序是:⑤>②>①>④>③ |
| B.常温下,0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: c(B—)>c(H+)>c(Na+)>c(OH—) |
| C.常温下,将CH3COONa、HCl两溶液混合后,溶液呈中性,溶液中c(Na+)大于c(Cl-)。 |
| D.pH相等的下列溶液:a.CH3COOK、b.NaHCO3、c.Na2CO3、d.NaOH,其物质的量浓度由小到大顺序 为:d<c<a<b |
25℃时,浓度均为0.1mol·L-1的HA溶液和BOH溶液,pH分别是1和12。下列说法正确的是
| A.在0.1 mol·L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-) |
| B.若将0.1mol·L-1BOH溶液稀释至0.001 mol·L-1则溶液的pH=10 |
| C.若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) |
| D.若将上述两溶液按体积比l:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
电离度是指弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数,下表中是三种酸在相同温度下的一些数据,有关判断正确的是
| 酸 |
HX |
HY |
HZ |
||
| 浓度(mol/L) |
0.12 |
0.2 |
0.9 |
1 |
1 |
| 电离度 |
0.25 |
0.2 |
0.1 |
0.3 |
0.5 |
| 电离常数 |
K1 |
K2 |
K3 |
K4 |
K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/[c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ混合后,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
下列溶液中微粒的物质的量浓度关系正确的是
| A.常温下0. 1 mol·L-1的下列溶液中:① NH4Al(SO4)2、② NH4Cl、③ CH3COONH4,c(NH4+)由大到小的顺序为②>①>③ |
| B.常温下0.4 mol·L-1CH3COOH溶液和0.2 mol·L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C.0.1 mol·L-1 Na2CO3溶液与0.2 mol·L-1 NaHCO3溶液等体积混合所得溶液中: c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
| D.0.1 mol·L-1的氨水与0.05 mol·L-1 H2C2O4溶液等体积混合所得溶液中: |
c(NH4+)+c(NH3·H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)
Ⅰ.在含有弱电解质的溶液中,往往有多个化学平衡共存。一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入少量CH3COONa固体。
(1)CH3COOH溶液的电离平衡 移动(填“向左”、“向右”或“不”),溶液中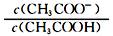 (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若该溶液呈酸性,则溶液中各离子浓度由大到小的顺序为: 。
Ⅱ、开发新能源和三废处理都是可持续发展的重要方面。
(1)H2、CO、CH3OH都是重要能源物质,它们燃烧热依次为285.8KJ/mol、281.5KJ/mol、726.7KJ/mol.已知CO、H2在一定条件下可以合成甲醇CO(g)+2H2(g)=CH3OH(l)。则该合成甲醇的热化学方程式为
(2)CO在催化剂作用下可以与H2反应生成甲醇:
CO(g)+2H2(g) CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。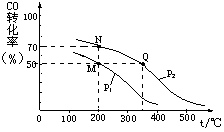
则M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 ;P1 P2(填“>”或“<”或“=”);
M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总= 。
水的电离平衡曲线如下图所示。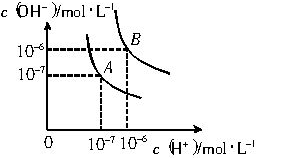
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为 。
(4))25℃时,在等体积的 ① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是 。
(5)等体积的下列溶液中,阴离子的总物质的量最大的是_________(填序号)。
① 0.1 mol·L-1的CuSO4溶液
② 0.1 mol·L-1的Na2CO3
③ 0.1 mol·L-1的KCl
④ 0.1 mol·L-1的NaHCO3
(6)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H+ + HA-,HA- H+ + A2- 。
H+ + A2- 。
①则Na2A溶液显________(填“酸性”“中性”或“碱性”);NaHA溶液显________(填“酸性”“中性”或“碱性”)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
| A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |
| B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+) |
| C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-) |
| D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-) |
常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法正确的是: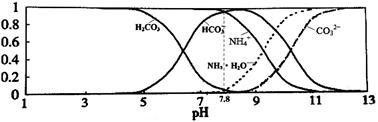
| A.当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-) |
| B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) |
| C.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 |
| D.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3) |
25℃时,将氨水与氯化铵溶液混合得到 c(NH3·H2O)+c(NH4+) =" 0.1" mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述一定正确的是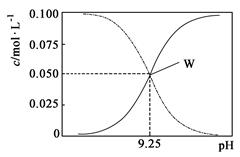
| A.W点表示溶液中:c(NH4+) +c(H+) = c(OH-) |
| B.pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1 mol·L-1 |
| C.pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+) |
| D.向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+) |
(15分)工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素)。
请回答下列问题:
(1)装置I中生成HSO-3的离子方程式为 。
(2)含硫各微粒(H2SO3、HSO-3和SO2-3)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如下图所示。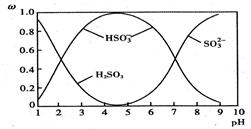
①下列说法正确的是 (填标号)。
| A.pH = 7时,溶液中c( Na+) < c (HSO-3) + c(SO2-3) |
| B.由图中数据,可以估算出H2SO3的第二级电离平衡常数K2≈10-7 |
| C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜 |
| D.pH = 9时溶液中 c(OH-)=" c" (H+) + c(HSO-3)+ 2c(H2SO3) |
②向pH = 5的NaHSO3溶液中滴加一定浓度的 CaCl2溶液,溶液中出现浑浊,其pH 降为2 ,用化学平衡移动原理解释溶液 pH 降低的原因 。
(3)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO-2离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。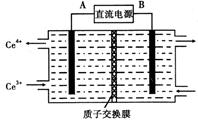
图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(5)已知进人装置Ⅳ的溶液中NO-2的浓度为 0.75 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L 。
试题篮
()