(本题共11分)氮族元素按原子序数增大,依次为:氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)。请回答:
28.常温常压下,向100mL 1.6mol/L稀氨水中逐滴滴入10mL 4.0mol/L稀硫酸,得到的溶液能使酚酞显红色。请比较所得溶液中NH4+、 NH3﹒H2O、SO42— 三种微粒的物质的量浓度大小关系: 。
29.含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢在热玻璃管中完全分解成氢气和1.50 mg单质砷。则在整个过程中,转移的电子总数为 。
30.铋酸钠(NaBiO3)溶液呈无色。向硫酸锰溶液中依次滴加下列溶液,对应的现象如表所示:
| 加入溶液 |
①适量铋酸钠溶液 |
②过量的双氧水 |
③适量KI淀粉溶液 |
| 实验现象 |
溶液呈紫红色 |
紫红色消失,产生气泡 |
溶液变成蓝色 |
请比较实验中所有的氧化剂和氧化产物的氧化性强弱关系(反应过程中的涉及的气体均不参与比较): 。
31.五氟化锑(SbF5)是无色黏稠液体,是很强的具有特殊酸性的酸,而且是超强酸氟锑酸HSbF6(目前酸性最强的酸,比纯硫酸强2×1019倍)的组分之一。SbF5可用于制备一般化学方法很难制备的氧化性极强的F2,其过程如下(均未配平):
①KMnO4 + KF + H2O2 + HF → K2MnF6 +O2 + H2O
②SbCl5 + HF → SbF5 + HCl
③K2MnF6 + SbF5 → KSbF6 + MnF3 + F2↑
反应①中氧化剂和被氧化的元素的物质的量之比为 ____;反应③中SbF5表现的性质为 ______性。
32.能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。例如:人体血液中HCO3—和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05。某同学取19ml 0.2mol/L的NaH2PO4溶液,81ml 0.2mol/L的Na2HPO4溶液混合,配制0.2mol/L PH=7.4的磷酸缓冲溶液。已知该缓冲溶液利用的平衡体系是:H2PO4— H++HPO42—,请根据该平衡体系分析其缓冲原理: 。
H++HPO42—,请根据该平衡体系分析其缓冲原理: 。
25°C时,c(CH3COOH)+c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液中,c(CH3COOH)、
c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是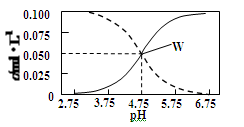
| A.pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| B.溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-) |
| C.由W点可以求出25°C时CH3COOH的电离常数 |
| D.pH=4的溶液中:c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1mol/L |
(1)某温度下,纯水中的c(H+)=3×10-7 mol/L,滴入稀H2SO4使c(H+)=5×10-6 mol/L,则c(OH-)=__ ,由水电离出的c(H+)为_____ 。
(2)现有常温下的五份溶液:
①0.01 mol·L-1 CH3COOH溶液;
②0.01 mol·L-1 HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol·L-1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(a)其中水的电离程度相同的是 ______;(填序号)
(b)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②、③混合(填“>”、“<”或“=”);
(c)将前四份溶液同等稀释10倍后,溶液的pH: ③________④ (填“>”、“<”或“=”);
(3)现有十种物质:①蔗糖 ②熔融NaCl ③盐酸 ④铜丝 ⑤NaOH固体
⑥液氯 ⑦CuSO4固体 ⑧酒精 ⑨氯水 ⑩H2SO4
a.上述物质中可导电的是 (填序号,以下同);
b.上述物质中属于非电解质的是 。
下列说法或解释不正确的是
| A.物质的量浓度均为1mol•L-1的NaCl和MgCl2中:c(Cl-)=3c(Na+) |
| B.等物质的量浓度的下列溶液中,①NH4Al(SO4) 2、②NH4Cl、③CH3COONH4、④ NH3·H2O,c(NH+4)由大到小的顺序是①>②>③>④ |
| C.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+) |
| D.向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液:c(CO)>c(HCO)>c(OH-)>c(H+) |
25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线下图所示,下列说法正确的是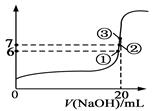
| A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等 |
| B.在①点时pH=6,溶液中:c(F-)-c(Na+) = 9.9×10-7mol/L |
| C.在②点时,溶液中:c(F-) < c(Na+) |
| D.在③点时V=20mL,溶液中:c(F—) < c(Na+)=0.1mol/L |
25℃时,取浓度均为0.1000mol·L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol·L-1NaOH溶液、0.1000mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如下图所示。下列说法不正确的是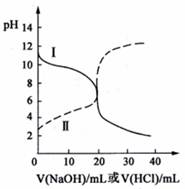
| A.根据滴定曲线可得,25℃时Ka(CH3COOH)≈Kb(NH3·H2O)≈10-5 |
| B.当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和曲线Ⅱ刚好相交 |
| C.曲线Ⅱ:滴加溶液至10.00mL时,溶液中c(CH3COO-) + c(OH-)>c(CH3COOH) + c(H+) |
| D.在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小 |
(15分)Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制取氢气:BH4- + 2H2O ="=" BO2- + 4H2↑(反应实质为水电离出来的H+被还原)。研究表明,该反应生成H2的速率受外界条件影响,下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间)。
| 体系 pH |
不同温度下的半衰期(min) |
|||
| 0℃ |
25℃ |
50℃ |
75℃ |
|
| 8 |
4.32×100 |
6.19×10-1 |
8.64×10-2 |
1.22×10-2 |
| 10 |
4.32×102 |
6.19×101 |
8.64×100 |
1.22×100 |
| 12 |
4.32×104 |
6.19×103 |
8.64×102 |
1.22×102 |
| 14 |
4.32×106 |
6.19×105 |
8.64×104 |
1.22×104 |
(1)已知NaBH4与水反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因 ,溶液中各离子浓度大小关系为 。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响? 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响? 。
Ⅱ.肼(N2H4)又称联氨,常温下是一种无色油状液体,沸点为113.5℃。肼和氧气在不同温度和催化剂条件下生成不同产物(如图)。
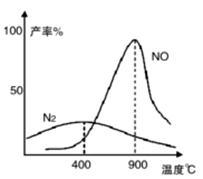
温度较低时主要反应①:N2H4 + O2  N2 + 2H2O
N2 + 2H2O
温度较高时主要反应②:N2H4 + 2O2 2NO + 2H2O
2NO + 2H2O
不考虑其他反应,完成下列填空:
(4)若反应①在250℃时的平衡常数为K1,350℃时的平常数 为K2,则K1 K2(填“>”、“<”或“=”)。
(5)反应于1100℃时达到平衡后,下列措施能使容器中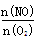 增大的有 (填字母序号)。
增大的有 (填字母序号)。
A.恒容条件下,充入He气 B.增大容器体积
C.恒容条件下,充入N2H4 D.使用催化剂
(6)若将n mol肼和2n molO2充入某容积为n L的刚性容器中,在800℃和一定压强、合适催化剂的作用下,反应①和②同时达到平衡,实验测得N2的产率x,NO的产率为y,则该条件下反应②的平衡常数K= (用x、y的代数式表示,不必化简)。
(12分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
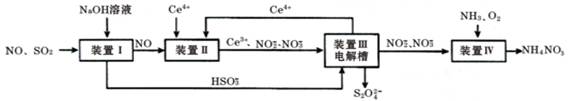
(1)装置Ⅰ中,NaOH溶液吸收SO2也可生成Na2SO3和NaHSO3的混合溶液
①写出NaOH溶液吸收SO2生成等物质的量的Na2SO3和NaHSO3混合溶液时总反应的离子方程式 。
②已知混合液pH随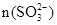 :n(
:n( )变化关系如下表:
)变化关系如下表:
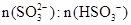 |
91:9 |
1:1 |
9:91 |
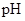 |
8.2 |
7.2 |
6.2 |
当混合液中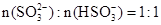 时,c(Na+) c(HSO3-)+ 2c(SO32-)(填“>”“=”或“<”)
时,c(Na+) c(HSO3-)+ 2c(SO32-)(填“>”“=”或“<”)
(2)装置Ⅱ中,酸性条件下,NO被Ce4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO2-的离子方程式 ;
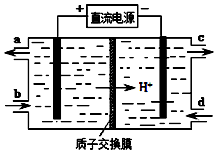
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
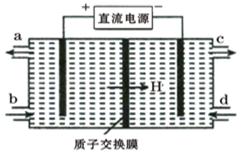
①生成的Ce4+从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NO3-,至少需向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示)
【原创】据中国地震台网测定,3月30日在贵州省黔东南苗族侗族自治州发生5.5级地震,据了解,这已经是贵州这个月以来发生的第三次地震。饮用水安全在灾后重建中占有极为重要的地位,为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究。
(1)下面是某同学从超市购买的某品牌消毒液包装说明查询到的部分内容:主要有效成分为次氯酸钠,有效氯含量8 000~ 10 000 mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。本品须密封,置阴凉暗处保存。据此分析:
①室温时,他测得该消毒液(NaClO)的pH_______7(填“>”、“=”或“<”),其原因为(用离子方程式表示)_________________________。
②该消毒液还具有的化学性质有____(填序号)
| A.强氧化性 | B.强还原性 | C.不稳定性 | D.漂白性 |
③从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示)_________________。
④日常生活中也常用明矾作净水剂,用离子方程式表示其净水原理___________________。
(2)该学习小组同学用石墨和饱和食盐水设计了如图所示的装置,进行消毒液( NaClO 溶液)制备,通电时,电解饱和食盐水的化学方程式为_________________;为使生成的Cl2完全被吸收,则电源的a极应为___极(填“正”或“负”),溶液中生成NaClO的离子方程式为____________________。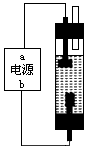
【改编】雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

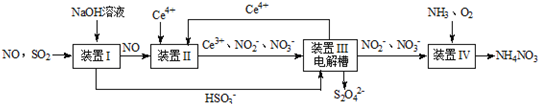
(1)装置Ⅰ的目的是 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1molNaOH反应后的溶液,测得溶液的pH=4时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程式 , 。
(4)装置Ⅲ中阴极反应方程式为 ;阳极使Ce4+再生,其原理如图所示。生成Ce4+从电解槽的 (填字母序号)口流出。
(5)若进入装置Ⅳ的溶液中的NO2-完全转化为NH4NO3,反应中氧化剂与还原剂的物质的量之比为 。
常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒的物质的量变化如下图(其中)Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,根据图示判断,下列说法正确的是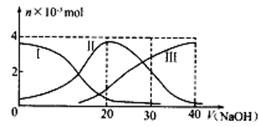
A.H2A在水中的电离方程式是:H2A=H++HA-;HA- H++A2-
H++A2-
B.当V(NaOH)=20mL时,溶液中各粒子浓度大小顺序为:c(Na+)> c(HA-) >c(H+) > c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+) + c(HA-)+ 2c(H2A) = c(A2-) + 2c(OH-)
【改编】工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下:
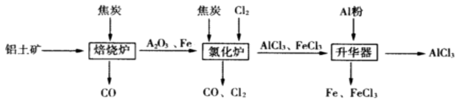
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,反应方程式为_____________,当反应掉2molAl2O3时需要焦炭________g,转移______mol电子;该制备流程中可以循环使用的物质有________________;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为_______。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为 。充分反应后温度降至_____以下(填“183℃、315℃之一),开始分离收集AlCl3。
②AlCl3溶于水后得到溶液显_______性(填“酸性、碱性”之一)为什么?_______________________,为得到AlCl3·3H2O会使用浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的 (填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)根据二氧化碳既不能燃烧,也不能支持燃烧的性质,人们研制了泡沫灭火器,灭火器内有两个容器,分别盛放两种液体,它们是Al2(SO4)3和NaHCO3溶液,两种溶液互不接触,不发生任何化学反应。(平时千万不能碰倒泡沫灭火器)当需要泡沫灭火器时,把灭火器倒立,两种溶液混合在一起,就会产生大量的二氧化碳气体,请写出相关化学方程式:_____________________;若灭火器中盛装了153.9g的硫酸铝与足量的碳酸氢钠,试问理论上可以放出CO2____________L(标准状况下)
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是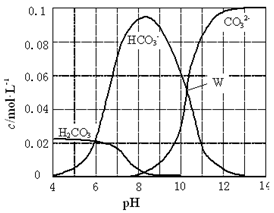
| A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-)=c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的HCO3-、CO32-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是
| A.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| B.V1:V2=l:5 |
| C.M点时生成的CO2为0.05mol |
| D.e曲线表示的离子方程式为: Al(OH)3+3H+= Al3++3H2O |
某学生对Na2SO3与AgNO3在不同PH下的反应进行探究。
(1)测得Na2SO3溶液PH=11,AgNO3溶液PH=5,二者水解的离子分别是 。
(2)调节PH,实验记录如下:
查阅资料得知:
i.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
ii.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将中滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据上述现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如下:
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
试题篮
()