常温下,在20 mL 0.1mol/L Na2CO3溶液中逐滴加入0.1 mol/L 盐酸40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示。下列说法不正确的是( )
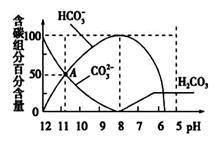
| A.0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B.在A点:c(Na+)> c(CO32-)> c(HCO3-)>c(OH-)>c(H+) |
| C.常温下CO2饱和溶液的pH约为5.6 |
| D.当加入20 mL盐酸时,混合溶液的pH约为8 |
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A.物质的量浓度相等的① NH4HSO4溶液、② NH4HCO3溶液、③ NH4Cl溶液中,pH的大小关系:②>①>③ |
| B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7时 c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) |
| C.将lmolNaClO和2molNaHCO3配制成1L混合溶液:c(HClO)+c(ClO-)=2c(HClO3-)+2c(H2CO3)+2c(CO32-) |
| D.浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则溶液中: |
C(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
一定温度下,向300 mL 1 mol/L的NaOH溶液中通入b mol CO2,下列说法正确的是
| A.通入CO2过程中溶液的Kw减小 |
| B.当b= 0.2时,所得溶液中部分离子浓度关系为:c (HCO3-) > c (CO32-) > c ( OH-) > c (H+) |
| C.b= 0.3与b= 0.15时,所得溶液中的微粒种类不相同 |
| D.当恰好生成NaHCO3时,溶液中存在:c(Na+)+c(H+)==c(HCO3-)+c( OH-) |
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
已知HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓;将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为( )
常温下,在10mL0.1 mol•L-1Na2CO3溶液中逐滴加入0.1 mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
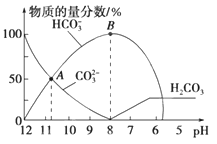
| A.在0.1mol•L-1Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20mL |
| C.在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图,下列分析正确的是( )

A.B点的横坐标a=12.5
B.C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
下列说法正确的是( )
| A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.室温下,水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
| C.相同温度下,等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为②>④>③>① |
| D.往0.1mol/LCH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中c(CH3COOH)/c(H+)·c(CH3COO-) 增大 |
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)>c(H+)>c(OH﹣)>c(A﹣)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(Na2CO3)<c(CH3COONa)<c(NaOH)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO﹣)+2c(OH﹣)=2c(H+)+c(CH3COOH)
D.0.1mol•L﹣1的NaHA溶液,其pH=4:c(HA﹣)>c(H+)>c(H2A)>c(A2﹣)
下列说法不正确的是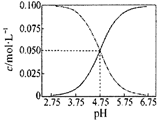
| A.在25℃时,将c mol·L-1的醋酸溶液与0.02mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10—9/(c—0.02) |
| B.0.1 mol·L-1醋酸溶液中:c(H+)2=c(H+)·c(CH3COO一)+KW |
| C.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO—)与pH值的关系如右图所示,当pH=4.5溶液中:c(CH3COOH)>c(CH3COO—)>c(H+)>c(OH—) |
| D.等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 |
常温下,在20.00 mL 0.100 0 mol·L-1 NH3·H2O溶液中逐滴滴加0.100 0 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示。下列说法正确的是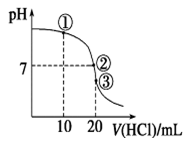
| A.①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.②溶液:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| C.①、②、③三点所示的溶液中水的电离程度②>③>① |
| D.滴定过程中不可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是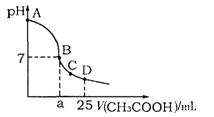
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
25℃时在10mL 0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
| A.Na2CO3溶液中c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| B.a、b曲线分别代表的是HCO3-、H2CO3量的变化情况 |
| C.A点时:c(Na+)>c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
| D.B点时加入盐酸的体积为10mL,两者恰好完全反应生成NaHCO3 |
常温下,下列有关叙述正确的是
| A.在0.1mol·L-1Na2C2O4溶液中:2c(Na+)=c(C2O42-)+c(HC2O4—)+c(H2C2O4) |
| B.向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液:c((CH3COO—)>c(Na+)>c(OH-)>c(H+) |
| C.浓度均为0. 1 mol·L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+) =" 2c" (CO32-) + c(OH-) + c(HCO3-) |
| D.浓度均为0. 1 mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合c(SO42-) =c(Na+)>c(NH4+)>c(H+)>c(OH-) |
CO2溶于水生成碳酸。已知下列数据:
现有常温下1 mol· L-1的(NH4)2CO3溶液,已知NH4+的水解平衡常数 第一步水解的平衡常数
第一步水解的平衡常数 。下列说法正确的是
。下列说法正确的是
A.由数据可判断该溶液呈酸性
试题篮
()