25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
| A.溶液的pH=5时,硫元素的主要存在形式为HSO3- |
| B.当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-) |
C.向pH=8的上述溶液中滴加少量澄清石灰水, 的值增大 的值增大 |
| D.向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小 |
已知:NH2COO-+2H2O HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
| A.无法判断T1和T2的大小关系 |
| B.T1℃时,第6min反应物转化率为6.25% |
| C.T2℃时,0~6min ν(NH2COO-)=0.3mol·L-1·min-1 |
| D.往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小 |
下列说法正确的是
| A.常温下,0.1 mol/L的下列溶液①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4⑤(NH4)2SO4中,c(NH4+)由大到小的顺序是:⑤>②>①>④>③ |
| B.常温下,0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: c(B—)>c(H+)>c(Na+)>c(OH—) |
| C.常温下,将CH3COONa、HCl两溶液混合后,溶液呈中性,溶液中c(Na+)大于c(Cl-)。 |
| D.pH相等的下列溶液:a.CH3COOK、b.NaHCO3、c.Na2CO3、d.NaOH,其物质的量浓度由小到大顺序 为:d<c<a<b |
25℃时,浓度均为0.1mol·L-1的HA溶液和BOH溶液,pH分别是1和12。下列说法正确的是
| A.在0.1 mol·L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-) |
| B.若将0.1mol·L-1BOH溶液稀释至0.001 mol·L-1则溶液的pH=10 |
| C.若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) |
| D.若将上述两溶液按体积比l:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
电离度是指弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数,下表中是三种酸在相同温度下的一些数据,有关判断正确的是
| 酸 |
HX |
HY |
HZ |
||
| 浓度(mol/L) |
0.12 |
0.2 |
0.9 |
1 |
1 |
| 电离度 |
0.25 |
0.2 |
0.1 |
0.3 |
0.5 |
| 电离常数 |
K1 |
K2 |
K3 |
K4 |
K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/[c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ混合后,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
下列溶液中微粒的物质的量浓度关系正确的是
| A.常温下0. 1 mol·L-1的下列溶液中:① NH4Al(SO4)2、② NH4Cl、③ CH3COONH4,c(NH4+)由大到小的顺序为②>①>③ |
| B.常温下0.4 mol·L-1CH3COOH溶液和0.2 mol·L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C.0.1 mol·L-1 Na2CO3溶液与0.2 mol·L-1 NaHCO3溶液等体积混合所得溶液中: c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
| D.0.1 mol·L-1的氨水与0.05 mol·L-1 H2C2O4溶液等体积混合所得溶液中: |
c(NH4+)+c(NH3·H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)
常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法正确的是: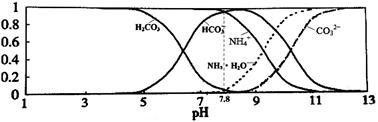
| A.当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-) |
| B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) |
| C.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 |
| D.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3) |
25℃时,将氨水与氯化铵溶液混合得到 c(NH3·H2O)+c(NH4+) =" 0.1" mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述一定正确的是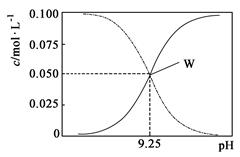
| A.W点表示溶液中:c(NH4+) +c(H+) = c(OH-) |
| B.pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1 mol·L-1 |
| C.pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+) |
| D.向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+) |
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是
| A.H3PO4的Ka3=10–12.2,HPO42–的水解平衡常数为10–6.8 |
| B.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性 |
| C.pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42–)>c(PO43-)>c(OH-)>c(H+) |
| D.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
下列说法正确的是
| A.一定温度下,10mL 0.50mol·L-1 NH4Cl溶液与20mL 0.25mol·L-1 NH4C1溶液含NH4+物质的量相同 |
B.25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3·H2O的电离常数 |
C.一定温度下,已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO- +H+,加少量烧碱溶液可使溶液中 CH3COO- +H+,加少量烧碱溶液可使溶液中 值增大。 值增大。 |
| D.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
现有室温下四种溶液,有关叙述不正确的是
| 编号 |
① |
② |
③ |
④ |
| pH |
10 |
10 |
4 |
4 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va + Vb),若混合后溶液pH = 5,则Va : Vb =" 11" : 9
室温下,下列溶液中粒子浓度大小关系正确的是
| A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B.pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① |
| C.0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| D.上图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
25℃时在10 mL 0.1mol·L—1Na2CO3溶液中逐滴加入0.1 mol·L—1HCl溶液20 mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
| A.HCl溶液滴加一半时,溶液pH>7 |
| B.当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol·L—1 |
| C.0.1 mol·L—1Na2CO3溶液中c(Na+)+c(H+)=c(OH—)+2c(CO32—)+c(HCO3—) |
| D.在M点:c(Na+)>c(CO32—)=c(HCO3—)>c(OH—)>c(H+) |
25℃下,向20 mL 0.1 mol·L-1H2A溶液中滴加0.1 mol·L-1NaOH溶液,有关粒子物质的量的变化如图所示。下列有关说法正确的是

下表是在相同温度下三种酸的一些数据,下列判断正确的是
| 酸 |
HX |
HY |
HZ |
||
| 浓度(mol/L) |
0.12 |
0.2 |
0.9 |
1 |
1 |
| 电离度 |
0.25 |
0.2 |
0.1 |
0.3 |
0.5 |
| 电离常数 |
K1 |
K2 |
K3 |
K4 |
K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合液,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
试题篮
()