(18分)C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1;S(s)+O2=SO2(g) △H=-296.0 kJ·mol-1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:2 SO2 (g)+O2 (g) 2 SO3 (g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
2 SO3 (g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
(3)如图所示, A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为N2(g)+3H2(g)  2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。
①下列示意图正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是___。
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)=____。
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为_______ (用c1、c2、c3和>、<、=表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,则该温度下0.1 mol·L-1的NH4Cl溶液的pH为_________。
对气体的转化与吸收的研究,有着实际意义。
(1)一定条件下,工业上可用CO或CO2与H2反应生成可再生能源甲醇,反应如下:
3H2(g)+CO2(g) CH3OH(g)+H2O(g) △H1=-49.0KJ/mol K1(Ⅰ)
CH3OH(g)+H2O(g) △H1=-49.0KJ/mol K1(Ⅰ)
2H2(g)+CO(g) CH3OH(g) △H2=-90.8KJ/mol K2(Ⅱ)
CH3OH(g) △H2=-90.8KJ/mol K2(Ⅱ)
则CO(g)+H2O(g) CO2(g)+H2(g)的△H3= KJ/mol和K3= (用K1和K2表示)
CO2(g)+H2(g)的△H3= KJ/mol和K3= (用K1和K2表示)
(2)在一定温度下,将0.2mol CO2和0.8mol H2充入容积为2L的密闭容器中合成CH3OH(g)。
5min达到平衡时c(H2O)=0.025mol/L,则5min内v(H2)= _______mol/(L·min)。下图图像正确且能表明该反应在第5min时一定处于平衡状态的是______。
若改变某一条件,达到新平衡后CO2的浓度增大,则下列说法正确的是_______。
a.逆反应速率一定增大 b.平衡一定向逆反应方向移动
c.平衡常数不变或减小 d.CO2的物质的量可能减小
(3)反应II可在高温时以ZnO为催化剂的条件下进行。实践证明反应体系中含少量的CO2有利于维持ZnO的量不变,原因是_________(写出相关的化学方程式并辅以必要的文字说明;已知高温下ZnO可与CO发生氧化还原反应)。
(4)实验室里C12可用NaOH溶液来吸收。室温下,若将一定量的C12缓缓通入0.2mol/L NaOH溶液中,恰好完全反应得溶液A,反应过程中水的电离程度________(填“变大”、“变小”或“不变”,下同), _________。溶液B为0.05mol/L的(NH4)2SO4溶液,则A、B两溶液中c(ClO-)、c(Cl-)、c(NH4+)、c(SO42-)由大到小的顺序为_________(已知:室温下HClO的电离常数Ka=3.2×10-8, NH3·H2O的电离常数Kb=1.78×10-5)。
_________。溶液B为0.05mol/L的(NH4)2SO4溶液,则A、B两溶液中c(ClO-)、c(Cl-)、c(NH4+)、c(SO42-)由大到小的顺序为_________(已知:室温下HClO的电离常数Ka=3.2×10-8, NH3·H2O的电离常数Kb=1.78×10-5)。
铁及其化合物有着广泛用途。
(1)将饱和三氯化铁溶液滴加至沸水中可制取氢氧化铁胶体,写出制取氢氧化铁胶体的化学方程式 。
(2)含有Cr2O72-的废水有毒,对人畜造成极大的危害,可加入一定量的硫酸亚铁和硫酸使Cr2O72-转化为Cr3+,该反应的离子方程式为 。然后再加入碱调节溶液的pH在6-8 之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
(3)铁镍蓄电池又称爱迪生蓄电池,放电时的总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,充电时阳极附近的pH (填:降低、升高或不变),放电时负极的电极反应式为 。
(4)氧化铁是重要的工业原料,用废铁屑制备氧化铁流程如下: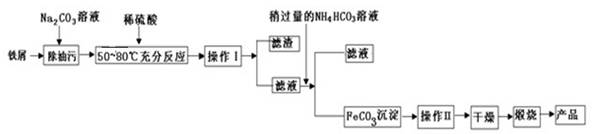
①铁屑溶于稀硫酸温度控制在50~800C的主要目的是 。
②写出在空气中煅烧FeCO3的化学方程式为 。
③FeCO3沉淀表面会吸附S042-,需要洗涤除去。
洗涤FeCO3沉淀的方法是 。
判断沉淀是否洗净的方法是 。
(14分)氨是重要的化工原料,可以制尿素等多种产品
(1)合成氨所用的氢气可以甲烷为原料制得,有关化学反应的能量变化如下图所示。
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合亚铜溶液来吸收原料氕中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l)
[Cu(NH3)3]CH3COO·CO(l)  H<0,吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 (填写选项编号)。
H<0,吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 (填写选项编号)。
A.高温、高压 B.高温、低压
C.低温、低压 D.低温、高压
(3)氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0,某温度下,向容器为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。该温度下次反应的平衡常数K为 。
CO(NH2)2(l)+H2O(g) △H<0,某温度下,向容器为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。该温度下次反应的平衡常数K为 。
(4)取两个相同的恒容容器,保持相同温度,并加入等量的CO2气体,根据实验数据绘制出(NH3)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则____(填“A”或“B”)曲线所对应的实验温度高,判断的依据是 。
(5)已知某些弱电解质在水中的电离平衡常数(25 ℃)如下表:
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+ )>c(CO32-)>c(HCO3- )>c(NH3·H2O)
B.c(NH4+ )+c(H+)=c(HCO3- )>c(OH-)+ c(CO32-)
C.c(HCO3- )+c(H2CO3)+ c(CO32-)="0.1" mol·L-1
D.c(NH4+ )+c(NH3·H2O)=2c(CO32-)>2c(HCO3- )+ 2c(H2CO3)
25℃时在10 mL 0.1mol·L—1Na2CO3溶液中逐滴加入0.1 mol·L—1HCl溶液20 mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
| A.HCl溶液滴加一半时,溶液pH>7 |
| B.当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol·L—1 |
| C.0.1 mol·L—1Na2CO3溶液中c(Na+)+c(H+)=c(OH—)+2c(CO32—)+c(HCO3—) |
| D.在M点:c(Na+)>c(CO32—)=c(HCO3—)>c(OH—)>c(H+) |
高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景。
(1)湿法制备K2FeO4:在KOH溶液中,用KClO直接氧化Fe(NO3)3即可制得K2FeO4。该反应的离子方程式为_________________________________。
(2)测定K2FeO4:样品纯度:i.称取样品mg,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;ii.将所得铬酸钠(Na2CrO4)溶液酸化;iii.在所得Na2Cr2O7溶液中加入8—9滴二苯胺磺酸钠溶液作指示剂,用c mol·L-1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL。整个过程中发生的反应如下:
ⅰ._Cr(OH)4-+_FeO42- +__ =__Fe(OH)3(H2O)3↓+__CrO42-+__
=__Fe(OH)3(H2O)3↓+__CrO42-+__
ⅱ.2CrO42- + 2H+=Cr2O72- + H2O;
ⅲ.Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O
①配平方程式i;
②利用上述数据计算该样品的纯度为________________(用含字母的代数式表示)。
(3)高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
①pH=2.2时,溶液中主要含铁形体浓度的大小关系为________;为获得尽可能纯净的高铁酸盐,pH应控制在______________。
②已知H3FeO4+的电离常数分别为:
当PH=4时,溶液中 =___________。
=___________。
③向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为______________。
(4)某新型电池以金属锂为负极,K2FeO4为正极,溶有LiPF6的有机溶剂为电解质。工作时Li+通过电解质迁移入K2FeO4晶体中,生成K2Li2FeO4。该电池的正极反应式为______________.
25℃下,向20 mL 0.1 mol·L-1H2A溶液中滴加0.1 mol·L-1NaOH溶液,有关粒子物质的量的变化如图所示。下列有关说法正确的是

下表是在相同温度下三种酸的一些数据,下列判断正确的是
| 酸 |
HX |
HY |
HZ |
||
| 浓度(mol/L) |
0.12 |
0.2 |
0.9 |
1 |
1 |
| 电离度 |
0.25 |
0.2 |
0.1 |
0.3 |
0.5 |
| 电离常数 |
K1 |
K2 |
K3 |
K4 |
K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合液,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
根据下列各图曲线表征的信息,得出的结论不正确的是
| A.图l表示常温下向体积为10 mL 0. 1 mol•L-1NaOH溶液中逐滴加入0. 1 mol•L-1CH3COOH液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
| B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸.II表示盐酸,且溶液导电性:c>b>a |
| C.图3表示H2与O2发生反应过程中的能量变化,H2的然烧热为285. 8kJ mol-1 |
| D.由图4得出若除去CuSO4洛液中的Fe3+,可采用向溶掖中加入适量CuO,调节溶液的PH至4左右 |
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 |
NaF |
NaClO |
Na2CO3 |
| pH |
7.5 |
9.7 |
11.6 |
下列有关说法正确的是。
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
②浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1 mol/L氨水中滴加0.l mol/L盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-a mol/L
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
| A.①④ | B.②④ | C.①③ | D.②⑤ |
SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中生成HSO3-的离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。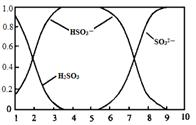
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。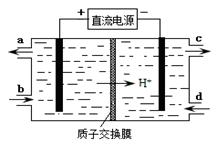
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L(用含a代数式表示,计算结果保留整数).
下列溶液或浊液中,关于离子浓度的说法正确的是
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳 源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。能判断该反应达到化学平衡状态的依据是_____________。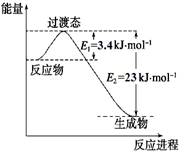
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol[ |
平衡量/mol |
达到平衡所需 时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正 V逆(填“<”,“>”,“=”)。
(3)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为________;
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。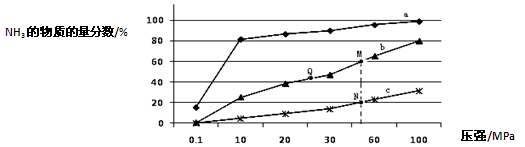
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
①当氨水中所含氨的物质的量3mol,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
②NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理: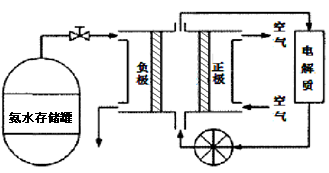
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方程式是 。
试题篮
()