室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
| |
加入的物质 |
结论 |
| A |
50mL 1 mol·L-1H2SO4 |
反应结束后,c(Na+)=c(SO42-) |
| B |
0.05molCaO |
溶液中  增大 增大 |
| C |
50mL H2O |
由水电离出的c(H+)·c(OH—)不变 |
| D |
0.1mol NaHSO4固体 |
反应完全后,溶液pH减小,c(Na+)不变 |
部分弱酸的电离平衡常数如下表:
| 弱酸 |
H2CO3 |
H2SO3 |
HClO |
| 电离平衡常数 (25℃) |
K1=4.30×10-7 K2=5.61×10-11 |
K1=1.54×10-2 K2=1.02×10-7 |
K=2.95×10-8 |
下列说法不正确的是( )
A.NaHSO3溶液中的离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
B.相同温度时三种溶液的pH关系:Na2CO3>NaClO>Na2SO3
C.ClO-+CO2+H2O=HClO+HCO3-
D.2ClO-+SO2+H2O=2HClO+SO32-
醋酸钡晶体[(CH3COO)2Ba·H2O]是一种媒染剂,下列有关0.1mol·L-1醋酸钡溶液中粒子浓度的比较中错误的是( )
| A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.c(H+)=c(OH-)-c(CH3COOH) |
| C.2c(Ba2+)=c(CH3COO-)+c(CH3COOH) |
| D.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-) |
下列溶液中相应关系正确的是( )
| A.0.2 mol·L-1CH3COONa溶液和0.1 mol·L-1HCl溶液等体积混合后: c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)>c(OH-) |
| B.pH=3的盐酸和NaNO3的混合溶液中:c(Na+)=c(Cl -) |
| C.0.1 mol·L-1NaHCO3溶液中: c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D.含SO42-、NH4+、H+、OH-的溶液中可能存在:c(H+)>c(SO42-)>c(NH4+)>c(OH-) |
室温时,向20 mL 0.1 mol/L醋酸溶液中不断滴入0.1 mol/L NaOH溶液,溶液pH变化曲线如图所示。下列关于溶液中离子浓度大小关系的描述正确的是
| A.a点时:c(CH3COOH) c(CH3COO-) c(H+) c(Na+) c(OH-) |
| B.b点时:c(Na+) c(CH3COO-) |
| C.c点时:c(H+)=c(CH3COOH)+c(OH-) |
| D.d点时:c(Na+) c(OH-) c(CH3COO-) c(H+) |
25 ℃时,浓度均为0.1 mol·L-1的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
| A.BOH溶于水,其电离方程式是BOH===B++OH- |
| B.若一定量的上述两溶液混合后pH=7,则c(A-)=c(B+) |
| C.在0.1 mol·L-1 BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+) |
| D.若将0.1 mol·L-1的BOH溶液稀释至0.001 mol·L-1,则溶液的pH=9 |
设某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,且X > 11将上述两溶液分别取等体积充分混合,混合液中各离子的浓度由大到小的顺序是( )
A.c(Cl-) c(NH4+) c(NH4+) c(H+) c(H+) c(OH-) c(OH-) |
B.c(NH4+) c(Cl-) c(Cl-) c(H+) c(H+) c(OH-) c(OH-) |
C.c(NH4+) c(Cl-) c(Cl-)  c(OH-) c(OH-) c(H+) c(H+) |
D.c(Cl-) c(NH4+) c(NH4+) c(OH-) c(OH-) c(H+) c(H+) |
在AlCl3和FeCl3的混合液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是( )
| A.Fe2S3、I2 | B.Al(OH)3、I2 | C.Fe(OH)3、Al(OH)3 | D.FeS、S、Al(OH)3 |
25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示,有关粒子浓度的关系中,不正确的是
| A.在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+) |
| B.在B点:c(Na+) ﹦c(CH3COO-) ﹥c(OH-)﹦c(H+), |
| C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-) |
| D.在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+) |
25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1HCl溶液等体积混合: c(Na+)=c(Cl-)>c(CH3COO-)>c(H+) |
| B.0.1 mol·L-1NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7): c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-) |
C.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合: c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.0.1 mol·L-1Na2C2O4溶液与0.1 mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸): |
2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
有一种酸式盐AHB,它的水溶液呈弱碱性。则以下说法:
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB A++HB-,HB-
A++HB-,HB- H++B2-
H++B2-
其中错误选项的组合是
| A.①② | B.③④ | C.②③ | D.①④ |
已知H2R为二元弱酸:H2R HR-+H+ Ka1 HR-
HR-+H+ Ka1 HR- R2-+H+ Ka2
R2-+H+ Ka2
常温下,向某浓度的H2R溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2R、HR-、R2-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
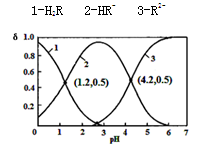
| A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2R) |
| B.pH=2.7溶液中:c2(HR-) / [c(H2R) × c(R2-)]= 1000 |
| C.将相同物质的量KHR和K2R固体完全溶于水可配得pH为4.2的混合液 |
| D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大 |
下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO )+c(HCO
)+c(HCO )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH)=l0-a mol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)-c(H2S)-c(HS-)
| A.①④ | B.②⑤ | C.①③ | D.②④ |
下列溶液中有关微粒的物质的量浓度关系正确的是
| A.同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl ③NH3·H2O ④CH3COONH4,其中c(NH4+)由大到小的顺序是:①>②>③>④ |
| B.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1 mol·L-1盐酸、 ③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③ |
| C.常温下将NaHSO3和NaHCO3两溶液混合后,溶液呈中性,则混合后的溶液中: c (Na+)=c(HSO3—)+c(HCO3—)+2c(CO32—)+2c(SO32—) |
| D.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ |
试题篮
()