下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液pH=7,c(Na+)="0.1" mol·L-1:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
25 ℃时,浓度均为0.1 mol·L-1的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是( )
| A.在0.1 mol·L-1BA溶液中,c(A-)+c(H+)=c(OH-)+c(B+) |
| B.若将0.1 mol·L-1 BOH溶液稀释至0.001 mol·L-1则溶液的pH=9 |
| C.若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) |
| D.若将上述两溶液按体积比1∶1混合,则混合液中:c(A-)>c(B+)>c(H+)>c(OH-) |
常温下,下列溶液中的粒子浓度关系正确的是( )
| A.NH4Cl溶液中:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+) |
| B.Na2SO4溶液中:c(Na+)+ c(H+)=c(SO42﹣)+ c(OH﹣) |
| C.NaHCO3溶液中:c(Na+)>c(HCO3﹣)>c(H+)>c(OH﹣) |
| D.浓度均为0.1 mol/L的CH3COOH与CH3COONa溶液等体积混合所得溶液中:c(CH3COOH)+c(CH3COO﹣)="0.1" mol/L |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合: c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.0.1mol·L-1CH3COONa溶液与0.1mol·L-1CH3COOH溶液等体积混合(pH=4.75): c (CH3COO-) + c (CH3COOH) =" 2" c(Na+) |
| C.0.1mol·L-1CH3COONa溶液与0.1mol·L-1 HCl溶液混合至pH=7: c(Na+)>c(Cl-) = c(CH3COOH)>c(CH3COO-) |
| D.0.1mol·L-1 Na2CO3溶液与0.1mol·L-1 NaHCO3溶液等体积混合: |
c (HCO3-) + 2c (H+) + 3c (H2CO3) = c(CO32-) + 2c(OH-)
常温下,用0.1000 mol•L-1 NaOH溶液滴定 20.00 mL 0.1000 mol•L-1 CH3COOH溶液滴定曲线如上右图。下列说法正确的是
| A.点①所示溶液中:c(CH3COO-)+ c(OH-)= c(CH3COOH)+ c(H+) |
| B.点②所示溶液中:c(Na+)= c(CH3COOH)+ c(CH3COO-) |
| C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)] |
常温下,下列说法正确的是
| A.在Na2CO3溶液中:c(OH﹣)﹣c(H+)=c(HCO3﹣)+c(H2CO3) |
| B.0.2mol•L-1的CH3COONa溶液与0.1mol•L-1的HCl溶液等体积混合,溶液显酸性: c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
| C.pH相同的碳酸钠溶液与碳酸氢钠溶液:c(NaHCO3)>c(Na2CO3) |
| D.0.1mol•L-1的HCN(弱酸)和0.1mol•L-1的NaCN等体积混合:c(HCN)+c(CN-) = c(Na+) |
已知:酸性H2CO3>HClO>HCO3-,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
| A.c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
| B.c(HCO3-)>c(ClO-)>c(OH-) |
| C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+c(CO32-) |
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)>c(H+)>c(OH﹣)>c(A﹣)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(Na2CO3)<c(CH3COONa)<c(NaOH)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO﹣)+2c(OH﹣)=2c(H+)+c(CH3COOH)
D.0.1mol•L﹣1的NaHA溶液,其pH=4:c(HA﹣)>c(H+)>c(H2A)>c(A2﹣)
下列说法正确的是
| A.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 |
B.0.1 mol·L-1的醋酸溶液加水稀释,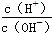 减小 减小 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
在常温下,下列关于电解质溶液的叙述一定正确的是
| A.将PH=a的NaOH溶液加水稀释至10n倍,则溶液的PH变为a-n |
| B.等浓度的氨水和NH4Cl溶液等体积混合后:c(NH32-)+ c(H+)> c(NH3·H2O)+ c(OH-) |
| C.向NaOH溶液中逐滴加入CH3COOH溶液至PH=7,水的电离程度逐渐增大 |
| D.PH=5.6的NaHSO3溶液:c(Na+)> c(HSO3-)> c(H2SO3) > c(SO32-) |
下列溶液中离子浓度关系的表示正确的是
| A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) |
| B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后:c(OH-)>c(H+)+c(CH3COO-) |
| C.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-) |
常温下,向l00mL 0.01mol•L﹣1HA溶液中逐滴加入0.02mol•L﹣1MOH溶液,如图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,正确的是
| A.HA为一元强酸,MOH为一元强碱 |
| B.K点所示溶液中c(A﹣)>c(M+) |
| C.N点水的电离程度小于K点水的电离程度 |
| D.K点溶液的pH=10,则有c(MOH)+c(OH﹣)﹣c(H+)=0.005mol•L﹣1 |
下列溶液或浊液中,关于离子浓度的说法正确的是
A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小
B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:
c(CO32-) > c(HCO3-),且2c(Na+)=3c(H2CO3)+3c(HCO3-)+3c(CO32-)
C.常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系: c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
D.假设HClO的电离平衡常数为Ka,碳酸的电离常数分别记为:Ka1和Ka2,已知:Ka1 > Ka > Ka2 , 则发生反应:2NaClO + CO2(少量)+H2O=Na2CO3+2HClO
常温下,向某浓度H2A溶液中逐滴加入一定量浓度NaOH溶液,所得溶液中H2A、HA﹣、A2﹣三种微粒的物质的量分数与溶液pH的关系如图所示,则下列说法中不正确的是
A.H2A是一种二元弱酸
B.常温下,H2A H++HA﹣的电离平衡常数Ka1=0.01
H++HA﹣的电离平衡常数Ka1=0.01
C.将相同物质的量的NaHA和Na2A固体溶于水所得混合溶液pH一定为5.5
D.在量热计中,用20.0mL0.10mol/LNaOH溶液,分别与10.0mL0.20mol/LH2A和20.0mL0.10mol/LH2A反应后放出的热量不相同
室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是:
| A.pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水大 |
| C.当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)= c(NH3·H2O) + c(OH-) |
| D.滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1 |
试题篮
()