常温下,下列溶液中有关物质的量浓度关系不正确的是
A.pH=2的HA溶液与pH=12的MOH溶液等体积混合后pH<7,则HA为弱酸
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度均为0.2mol·L-1CH3COOH和CH3COONa溶液等体积混合:2c(Na+) =c(CH3COO-) + c(CH3COOH)=0.2mol·L-1
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
关于离子浓度的关系,下列说法错误的是
A.等浓度的 、 、 混合溶液中: 混合溶液中:  |
B.新制氯水中: |
C.室温下,向0.01  溶液中滴加 溶液中滴加 溶液至中性: 溶液至中性: |
D.物质的量浓度均为 的 的 和 和 混合溶液中,离子浓度可能的关系为: 混合溶液中,离子浓度可能的关系为: |

常温下,用 0.1mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如右图所示。下列说法正确的是
| A.当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-) |
| B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-) |
| C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3) |
| D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
常温下,下列有关电解质溶液中相关微粒的物质的量浓度关系不正确的是
| A.0.1moI·L-lCH3COOH溶液中:c(CH3COO-)< c(H+) |
| B.0.1moI·L-lNH4Cl溶液中:c(NH4+)+c(H+)= c(Cl-)+c(OH-) |
| C.0.1moI·L-lNa2CO3溶液与0.1moI·L-lNaHCO3溶液等体积混合后的溶液中:c(HCO3-)+2c(CO32-)+c(H2CO3)=0.1moI·L-l |
| D.浓度均为0.1 moI·L-l的NH4C1、CH3COONH4、NH4HSO4溶液中,c(NH4+)的大小顺序为:CH3COONH4>NH4Cl>NH4HSO4 |
下列关于电解质溶液中离子浓度关系的说法正确的是
| A.0.1mol/L的NaHCO3溶液中离子浓度的关系:c(Na+)=c(HCO3-) + c(H2CO3) + 2c(CO32-) |
| B.0.1mol/L的NH4Cl溶液和0.1mol/L的NH3·H2O等体积混合后离子浓度的关系:c( Cl-)>c(NH4+)>c(H+)>c (OH-) |
| C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) |
| D.KHS溶液中存在等式关系:2c(S2-) + c(OH-) = c(H+) + c(H2S) |
常温下,下列溶液中的粒子浓度关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
C.25℃时,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液pH=4.75, |
| D.一定物质的量浓度的Na2S溶液中:c(OH-) =c(H+)+2c(H2S) + c(HS-) |
常温下,在25mL 0.1 mol·L-1 NaOH溶液中逐滴加入a mL 0.2 mol·L-1 CH3COOH溶液,有关混合溶液的判断正确的是
| A.当pH=7时,一定有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| B.当a=25时,一定有:c(CH3COO-)+c(CH3COOH)=c(Na+) |
| C.当c(CH3COO-)>c(Na+)时,a一定大于12.5 |
| D.当c(OH-)>c(H+)时,a一定小于12.5 |
如图为常温下,向25 mL某浓度的 NaOH溶液中逐滴加入0.2 mol·L-1 CH3COOH溶液的过程中溶液pH的变化曲线。下列说法不正确的是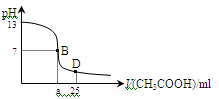
| A.NaOH溶液起始浓度为0. 1 mol·L-1 |
| B.a>12.5 |
| C.B点溶液中c(Na+)一定等于c(CH3COO-) |
| D.D点溶液中: c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
已知某酸H2B在水溶液中存在下列关系:①H2B H++HB-,②HB-
H++HB-,②HB-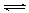 H++B2-。则下列关于酸式盐NaHB的说法中一定正确的是
H++B2-。则下列关于酸式盐NaHB的说法中一定正确的是
A.NaHB的电离方程式为:NaHB Na++H++B2- Na++H++B2- |
| B.NaHB溶液一定显碱性 |
C.NaHB和NaOH溶液反应的离子方程式为H++OH- H2O H2O |
| D.NaHB溶液中一定存在:c(Na+)+c(H+)=c(HB-)+2c(B2-)+c(OH-) |
某化学研究性学习小组对溶液作如下的归纳总结(均在常温下)。其中正确的是
①pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位
②1 L 0.50 mol·L-1 NH4Cl 溶液与2 L 0.25 mol·L-1 NH4Cl 溶液含NH4+物质的量前者大
③在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,则原溶液中一定有CO32-
④pH=4、浓度均为0.1 mol·L-1 的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na +) mol/L
| A.①② | B.②③ | C.①③ | D.②④ |
下列离子方程式正确的是
A.NaHS溶液水解的方程式为:HS-+H2O S2-+H3O+ S2-+H3O+ |
| B.向H218O中投入Na2O2固体: 2H218O + 2Na2O2 ===4Na++ 4OH-+ 18O2↑ |
| C.在100 mL 2 mol/L FeBr2溶液中通入4.48 L氯气(标况下),充分反应:2Fe2+ + 2Br-+ 2Cl2="==" 2Fe3++Br2+4Cl- |
D.用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ H2↑+Cl2↑ H2↑+Cl2↑ |
下列关于溶液中离子的说法不正确的是
| A.0.1 mol·L-1的Na2CO3溶液中粒子浓度关系:c (Na+)=2c (CO32-)+2c (HCO3-)+2c (H2CO3) |
| B.常温下,氢氧化钠溶液中滴入醋酸使溶液的pH=7,则混合溶液中醋酸已过量 |
| C.0.2 mol·L-1的HCl和0.1 mol·L-1的NH3·H2O等体积混合后溶液中的离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
| D.0.1 mol·L-1的NaHS溶液中离子浓度关系:c (S2-)+c (OH-)=c (H+)+c (H2S) |
下列指定条件下的结果正确的是
A.0.1mol·L—1氨水中,c(OH—)=c(NH4+)
B.10mL 0.02mol·L—1 HCl溶液与10mL 0.02mol·L—1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol·L—1 CH3COONa溶液中,c(OH—)=c(CH3COOH)+c(H+)
D.0.1mol·L—1某二元弱酸盐NaHA溶液中,c(Na+)=2c(A2—)+c(HA—)+c(H2A)
下列有关溶液的说法中,正确的是
| A.物质的量浓度相等的NH4Al(SO4)2、NH4HCO3、NH4Cl溶液中c(NH4+):NH4HCO3>NH4Cl>NH4Al(SO4) 2 |
| B.1.0mol/L Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.测得酸式盐NaHA溶液的pH=3,则NaHA在溶液中一定是电离大于水解 |
D.常温下0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c (Na )> c (B )> c (B )> c (H )> c (H )> c (OH )> c (OH ) ) |
25℃时在10mL 0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
| A.Na2CO3溶液中:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| B.a、b曲线分别代表的是HCO3-、H2CO3量的变化情况 |
| C.A点时:c(Na+)>c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
| D.B点时加入盐酸的体积为10mL,两者恰好完全反应生成NaHCO3 |
试题篮
()