下列溶液中微粒的物质的量浓度关系正确的是( )
A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)=c(NH )=c(Cl-) )=c(Cl-) |
| B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c(HCOO-)+ c(H+)>c(Na+)+c(OH-) |
| D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+) |
下列有关离子的各种说法中,正确的是
| A.金属钠溶于足量水中的离子方程式:Na+2H2O=Na++H2↑+2OH- |
| B.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、Cl-可以大量共存 |
| C.等物质的量浓度、等体积的氨水与盐酸混和,溶液中离子浓度关系为 c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中 c(K+)=c(H2X)+c(HX-)+c(X2-) |
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时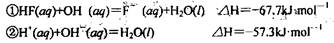
在20mL 0.1mol L-1氢氟酸中加入VmL 0.1 mol
L-1氢氟酸中加入VmL 0.1 mol L-1NaOH溶液,下列说法正确的是
L-1NaOH溶液,下列说法正确的是
已知常温下CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是( )
| A.a点表示的溶液中c(CH3COO-)略小于10-3 mol·L-1 |
| B.b点表示的溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中 均等于K 均等于K |
下列比较中,正确的是
| A.同温度同物质的量浓度时,HF比HCN电离平衡常数大,则NaF溶液的pH比NaCN溶液大 |
| B.0.2 mol·L-1 NH4Cl和0.1 mol·L-1 NaOH溶液等体积混合后:c(NH4+) > c(Cl-) > c(Na+) > c(OH-) > c(H+) |
| C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+) + c(H+)= 2c(S2-) + c(HS-)+c(OH-) |
| D.同浓度的下列溶液中,①NH4Al(SO4)2②NH4Cl ③CH3COONH4④NH3·H2O;c(NH4+) 由大到小的顺序是:③>②>①>④ |
已知酸H2B在水溶液中存在下列关系:①H2B =H++HB-,②HB- H++B2- ,则下列说法中一定正确的是
H++B2- ,则下列说法中一定正确的是
A.Na2B溶液中一定有: c(Na+) = 2[ c(B2-) + c(HB-) + c(H2B)]
B.Na2B溶液一定呈碱性,NaHB溶液可能呈酸性也可能呈碱性
C.NaHB水溶液中一定有:c(Na+) + c(H+) = c(HB-) + c(OH-) + c(B2-)
D.在Na2B溶液中一定有:c(OH-) = c(H+) + c(HB-)
在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是 
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)> c(OH—)>c(H+)
D.在D点:c(CH3COO-)+ c(CH3COOH)=2 c(Na+)
向盛有一定量氢氧化钠溶液的烧杯中通入标准状况下448mL氮气和二氧化碳的混合气体后得到溶液A,在溶液A中逐滴加入0.1 mol/L的稀盐酸至过量,并将溶液加热,产生的二氧化碳气体的物质的量与加入稀盐酸的体积的关系如图所示(忽略二氧化碳的溶解和氯化氢的挥发)。下列说法正确的是( )
| A.原混合气体中氮气与二氧化碳体积之比为1∶4 |
| B.在逐滴加入稀盐酸产生二氧化碳之前,发生的离子反应为CO32-+H-==HCO3- |
| C.溶 液 A 中 含 有 0 . 01 mol NaOH 和0.01 mol Na2CO3 |
| D.当加入0.1 L稀盐酸时,此时溶液中离子浓度大小关系为c(Na+)>c(Cl-)=c(CO32-)>c(OH-)>c(H+) |
下列有关电解质溶液中微粒的物质的量浓度关系错误的是( )
| A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液: c(HCO3-) > c(CO32-)> c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液[pH=7, c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
常温下,用0.1000 mol/L HCl溶液滴定20.00 mL 0.1000 mol/L NH3•H2O溶液,滴定曲线如下图。下列说法正确的是
| A.①溶液:c(C1—)>c(NH4+)>c(OH—)>c(H+) |
| B.②溶液:c(NH4+)=c(C1—)>c(OH—)=c(H+) |
| C.③溶液:c(H+)>c(NH3·H2O) + c(OH—) |
| D.滴定过程中可能出现:c(NH3•H2O)>c(NH4+)>c(OH—)>c(Cl—)>c(H+) |
缓冲溶液可以抗御少量酸碱对溶液pH的影响,Na2HPO4/Na3PO4的混合溶液可以将体系的pH稳定在11.3~13.3之间,是一种常用的缓冲溶液。下列有关该缓冲溶液的说法错误的是
| A.加入少量强碱,主要发生的反应HPO42-+OH-==PO43-+H2O |
| B.加入少量强酸,主要发生的反应HPO42-==2H++ H3PO4 |
| C.c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42- )+3c(PO43- ) |
| D.c(Na+)>c(PO43- )+c(HPO42- )+c(H2PO4- )+c(H3PO4) |
下列溶液中微粒浓度关系一定正确的是( )
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl﹣)>c(NH4+) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH﹣)=c(H+) |
| C.0.1mol•L﹣1的硫酸铵溶液中:c(NH4+)>c(SO42﹣)>c(H+) |
| D.0.1mol•L﹣1的硫化钠溶液中:c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S) |
下列溶液中,微粒浓度关系正确的是( )
| A.含有 NH4+、Cl-、H+、OH-的溶液中,其离子浓度可能是c(Cl-)> c(NH4+)>c(OH-)>c(H+) |
| B.常温下pH=6的醋酸与醋酸钠的混合溶液中c(Na+)>c(CH3COO-) |
| C.0.1 mol·L-1的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D.常温下pH=3的一元酸和pH=11的一元碱等体积混合后的溶液中一定是c(OH-)=c(H+) |
下列有关判断正确的是( )
| A.0.1mol/LNa2CO3溶液:c(OH-)= 2c(H2CO3)+ c(HCO3-)+ c(H+) |
B.能使紫色石蕊试液呈红色的溶液:Na+、NH 、I-、NO 、I-、NO 可以大量共存 可以大量共存 |
| C.任何条件下,pH=13的氢氧化钠溶液中:c(OH-)=0.1mol/L |
| D.NH4HCO3溶于过量的NaOH溶液中:HCO3-+ OH-= CO32- + H2O |
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为
0.1 mol·L-1的4种钠盐溶液的pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中正确的是( )
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HS )>c(S
)>c(S )>c(OH-)
)>c(OH-)
试题篮
()