(6分)按要求回答下列问题
(1)已知反应:mA(g) + nB(g) pC(g) + qD(g),v(A):v(B)= _________________;
pC(g) + qD(g),v(A):v(B)= _________________;
(2)任何情况下判断水溶液呈中性的依据是:_______________;
(3)NH4Cl溶液中离子浓度由大到小的顺序是:_________________。
(6分)完成下列离子反应方程式
(1)AlCl3溶液与Na2CO3溶液混合:____________;
(2)向AgCl固体上滴加Na2S溶液,固体变黑色:_________________;
(3)铁在潮湿的空气中发生电化腐蚀时,正极反应式:_________________。
(6分)完成下列离子反应方程式
(1)AlCl3溶液与Na2CO3溶液混合:______________;
(2)向AgCl固体上滴加Na2S溶液,固体变黑色:_________________;
(3)铁在潮湿的空气中发生电化腐蚀时,正极反应式:_________________。
下表是几种弱酸常温下的电离平衡常数:
 |
 |
 |
 |
 |
 |
 |
 |
(1)CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为 。
(2)多元弱酸的二级电离程度远小于一级电离的原因是 。
(3)同浓度的CH3COONa、NaHCO3、Na2CO3、Na2S溶液的pH由大到小的顺序为 。
完成下列化学用语的书写:
(1)用离子方程式表示碳酸钠溶液显碱性的原因:__________ _________。
(2)实验室配制的CuSO4溶液,常常出现浑浊的原因是
(写离子方程式),可采取在配制时加入少量 防止出现浑浊。
(3)泡沫灭火器中盛放的灭火剂包括Al2(SO4)3溶液(约1 mol/L)、NaHCO3溶液(约1 mol/L)及起泡剂。使用时发生反应的离子方程式是_____ _______________________ ____
(4)已知断裂1 mol H2(g)中的H—H键需要吸收436kJ的能量,断裂1 mol O2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1mol H—O键能放出463kJ的能量。试写出O2(g)与H2(g)反应生成H2O(g)的热化学方程式: 。
(10分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________。
(2)B为0.1 mol·L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:________________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入________,目的是_______________;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为__________________。
现有NH4Cl和氨水组成的混合溶液。请回答下列问题(填“>”、“<”或“=”):
(1)若溶液的pH=7,则该溶液中c(NH )_________c (Cl—)。
)_________c (Cl—)。
(2)若溶液的pH>7,则该溶液中c(NH+)_________c(Cl—)。
(3)若c(NH )<c (Cl—),则溶液的pH__________7。
)<c (Cl—),则溶液的pH__________7。
(8分)(1)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为:
②当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3·H2O)_______n(HCl),溶液中c( NH4+)_______c(Cl-)。(填“>”或“<”或“=” )
(2)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_ __和_ _两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多0.05mol。
请根据所学化学知识回答下列问题:
(1)氯化铁溶液蒸干并灼烧后得到的固体物质的化学式是________。
(2)在浓度均为0.1 mol/L的①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4四种溶液中,NH4+浓度由大到小的顺序为________(用代号表示)。
(3)25时,某浓度的CH3COONa溶液呈碱性的原因是________(用离子方程式表示),溶液中所有离子的浓度由大到小的顺序是________。
(4)某温度下,蒸馏水的pH = 6,氢氧化物R(OH)2的Ksp = 1×10-13,则R2+沉淀完全时,溶液的pH为_______。
(共10分)常温下,如果取0.1 mol HA溶液与0.1mol
HA溶液与0.1mol  NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:____(用离了方程式表示)。
(2)混合溶液中由水电离出的c(OH-)=____
(3)求出混合溶液中下列算式的精确计算结果(填具体数值):
(4)己知NH4A 溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH3)2CO3溶液的pH_____7(填“>”、“<”或“=”);
(共8分)
(1)物质的量浓度相同的①氨水;②氯化铵;⑧碳酸氢铵;④硫酸氢铵;⑤硫酸铵5种溶液中c(NH4+)的大小顺序是______,溶液pH的大小顺序是______。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 ..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 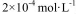 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)己知: 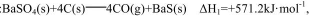

则反应 
工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①常温下,测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因 。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为 。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)  Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①H2S气体与足量NaOH溶液反应的化学方程式
②铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式: 。
试题篮
()