I.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_________________________________________。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
请完成下列问题。
①试比较K1、K2的大小,K1___________K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是______________(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正______________v(N2)逆(填写“>”、“=”或“<”)。
II.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。
| 酸或碱 |
电离平衡常数(Ka或 Kb) |
| CH3COOH |
1.8×10-5 |
| HNO2 |
4.6×10-4 |
| HCN |
5×10-10 |
| HClO |
3×10-8 |
| NH3·H2O |
1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是_________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是_________________(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈____(选填“酸性”“中性”或“碱性”),理由是:__________________________,溶液中各离子浓度大小的关系是__________________________________。
(每空1分,共11分)写出有关离子方程式
(1)Na2SO4溶液中滴加Ba(OH)2:
(2)H2S的电离方程:
(3)NH4Cl溶液显 性:
(4)纯碱溶液显 性:
(5)将FeCl3饱和溶液滴入沸水中:
(6)用明矾净水:
(7)在配制AlCl3溶液时,为了防止发生水解,可以加入少量的 ;在配制FeSO4溶液时,为了防止溶液变质,可以加入少量的 和 。
室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7 HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
硝酸铵在现代农业生产和国防中都占有重要地位,下图是云南天然气化工厂合成硝酸铵的简要生产工艺流程:
回答下列问题:
(1)N2的电子式 ,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 。
(2)氨催化氧化的化学方程式是 ,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响 。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法 。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答) 。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将 (填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为 (25℃时,Kb(NH3·H2O)="2.0" × 10-5 mol·L-1)。
(1)AgNO3的水溶液呈 (填“酸”“中”或“碱”)性,原因是(用离子方程式表示): ;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”或“抑制”)其水解。
(2)明矾溶于水其中铝离子水解可用于净水,用离子方程式表示:
(3)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示):
(16分)实验室中以粗铜(含杂质)为原料,某种制备铜的氯化物的流程如下:
按要求回答下列问题:
(1)操作①的所用到的玻璃仪器有______________。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是 ;
溶液1可加试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)___________。
A.NaOH B.NH3·H2O C.CuO D.CuSO4
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出
制备CuCl的离子方程式: 。
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
①按气流方向连接各仪器接口顺序是:a→ 、 → 、 → 、 → 。实验中大试管加热前要进行一步重要操作,其操作是 。
②反应时,盛粗铜粉的试管中的现象是 。
(5)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) + 4Cl-(aq)  CuCl42-(aq) + 4 H2O (l)
CuCl42-(aq) + 4 H2O (l)
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 (填序号)。
A.将Y稀释,发现溶液呈蓝色 B.在Y中加入CuCl2晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色 D.取Y进行电解,溶液颜色最终消失
常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1 L溶液
(1)该溶液中除H2O的电离平衡外还存在的平衡体系是__________。
(2)溶液中共有________种不同的微粒。
(3)这些粒子中浓度为0.01mol·L-1的是________,浓度为0.002mol·L-1的是_________。
(4)物质的量之和为0.01mol的两种微粒是__________。
(12分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-,HA-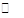 H++A2-。试回答下列问题:
H++A2-。试回答下列问题:
(1)NaHA溶液呈__ _(填“酸”“碱”或“中”)性,理由是 。
(2)某温度下,向10 mL、0.1 mol·L-1 NaHA溶液中加入0.1 mol·L-1 KOH溶液V mL至中性,此时溶液中以下关系一定正确的是 (填字母)。
| A.溶液pH=7 | B.水的离子积Kw=c2(OH-) |
| C.V>10 | D.c(K+) =c(Na+) |
(3)已知难溶物CaA在水中存在溶解平衡:CaA(s)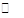 Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+) (填“减小”、“增大”或“不变”),原因是 。
Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+) (填“减小”、“增大”或“不变”),原因是 。
(4)测得25℃时,CaA的Ksp为2.0×10-11。常温下将10gCaA固体投入110mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.08 mol·L-1,则溶液中c(A2-)= 。
(1)写出下列化合物的结构简式
2,2,3,3,-四甲基戊烷:__________________________。
(2)①写出Na2CO3溶液与AlCl3溶液反应的离子方程__________________________。
②写出由甲苯制备TNT的化学方程式:__________________________。
③Na2CO3溶液显碱性,用离子方程式表示原因___________,其溶液中离子浓度大小顺序为___________。
(3)除去括号中的杂质,填上适宜的试剂和提纯方法
乙醇(水):__________、_________。
(4)甲烷燃料电池(在KOH环境中)的负极的电极反应式:___________________。
(5)将煤转化为煤气的主要化学反应为:C(s)+H2O(g)===CO(g)+H2(g)
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
H2(g)+ O2(g)===H2O(g) ΔH=-242.0 kJ/mol
O2(g)===H2O(g) ΔH=-242.0 kJ/mol
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ/mol
O2(g)===CO2(g) ΔH=-283.0 kJ/mol
根据以上数据,写出C(s)与水蒸气反应的热化学方程______________________。
0.1mol/L的NaHCO3溶液中
(1)按物质的量浓度由大到小顺序排列该溶液中各种离子浓度
(2)c(Na+)+c(H+)==
(3)c(Na+)==
在t℃时,某NaOH稀溶液中,C(H+)=10-a mol/L,C(OH-)=10-b mol/L,已知a+b=12,
则:
(1)该温度下,水的离子积常数Kw= ;(具体数值)
(2)该温度下,将100mL 0.1mol/L的稀硫酸与100mL 0.4mol/L的NaOH溶液混合(混合时溶液体积的变化忽略不计)后,溶液的pH= ,此时该溶液中由水电离的C(OH-)= mol/L;
(3)该温度下,CH3COOH和CH3COONa的混合溶液,若测得混合液的PH=6,则溶液中:C(CH3COO-)-C(Na+)= 。(具体数值)
(1)CuSO4的水溶液呈 (填“酸”、“中”、“碱”) 性,常温时的pH 7(填“>”或“=”或“<”),实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于硫酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)泡沫灭火器中的主要成分是Al2(SO4)3和NaHCO3溶液,反应的离子方程式为 。
下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1CH3COONa 溶液,并分别放置在盛有水的烧杯中,
然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
(1)含酚酞的0.01 mol·L-1CH3COONa溶液显浅红色的原因为(用离子方程式表达)________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是______。
| A.水解反应为放热反应 |
| B.水解反应为吸热反应 |
| C.NH4NO3溶于水时放出热量 |
| D.NH4NO3溶于水时吸收热量 |
(3)向0.01 mol·L-1CH3COONa溶液中分别加入NaCl固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为___________、______、_________。(填“左”、“右”或“不移动”)
(6分)现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3;②NaHCO3;③NaAlO2;④CH3COONa; ⑤NaOH,已知:CO2+3H2O+2AlO2- = 2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是: (填编号);
(2)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是: (填编号);
(3)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式: 。
试题篮
()