物质的量浓度都为0.1mol·L-1的CH3COOH与NaOH溶液等体积混合后,下列关系式不正确的是
| A.[Na+]+[H+]=[OH-]+[CH3COO-] |
| B.[Na+]>[CH3COO-]>[H+]>[OH-] |
| C.[OH-]=[H+]+[CH3COOH] |
| D.[CH3COOH]+[CH3COO-]=[Na+] |
(1)室温下,在pH=12的某种溶液中,由水电离的c(OH-)为 。
(2)等体积的下列溶液中,阳离子的总物质的量最大的是 。
①0.2 mol·L-1的CuSO4溶液 ②0.1 mol·L-1的Na2CO3
③0.2 mol·L-1的KCl ④0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是 。
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
NH4+、NO3-、HSO4-、HCO3-、CO32-、HCl等微粒中,在水溶液里能电离而不能水解的有___________;能水解而不能电离的有___________;既能水解又能电离的有__________;既不能水解又不能电离的有___________。写出其中既能水解又能电离的微粒的电离方程式及水解方程式_______________________,_________________________。
在世纪之交,罗马尼亚的炼金废水汇入尼罗河,导致大量鱼类等水生物死亡,造成世界级 的水污染事件。炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结
的水污染事件。炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结 合时生成剧毒的HCN。完成下列问题:
合时生成剧毒的HCN。完成下列问题:
(1)HCN的水溶液酸性很弱,其电离方程式为_________________,NaCN的水溶液呈碱性是因为_________________(用离子方程式表示)。
(2)室温下,如果将0.1mol NaCN和0.05mol HCl全部溶于水,形成混合溶液(假设无损失),
①__ _和_ __两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比H+多0.05mol。
(1)实验室在配制AgNO3的溶液时,常将AgNO3固体溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度而不是直接溶于水中,原因是(用离子方程式表示): ;
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
0.1mol/L的NaHCO3溶液中
c(Na+)+c(H+)==_______________,c(Na+)="=_______________" 。
(7分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA- HA-
H++HA- HA- H++A2-
H++A2-
已知相同浓度时的电离程度α(H2A)> α(HA-),设有下列四种溶液:
(A)0.01mol.L-1的H2A溶液
(B)0.01mol.L-1的NaHA溶液
(C)0.01mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
(D)0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1) c(H+)最大的是
(2)在0.01mol.L-1的NaHA溶液中2C(A2- )+(C(HA-)+C C(OH-)-C(H+)=
(3) 0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合显 性原因
(用离子方程式表示)
在配制Al2(SO4)3溶液时,铝离子会部分水解而使溶液呈酸性,水解的离子方程式为: 。为了防止发生水解,可以加入少量的 ;在Na2S溶液中,硫离子水解的离子方程是 ;为了防止水解,在配制该溶液时,可以加入少量的 。
(6分)
(1)NaHCO3的水溶液呈 (填“酸”、“中”、“碱”)性,实验室保存NaHCO3溶液的试剂瓶应用 塞,原因
(写出有关的离子方程式,下同);Al2(SO4)3显酸性,溶液蒸干最后得到的固体产物是
 ;
;
(2)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是
。
写出下列盐水解的离子方程式:
① CH3COONa
② (NH4)2SO4
③ NaHCO3
(4分)某可溶性盐的化学式XmYn(m≠n,X和Y不同时为弱电解质的对应离子),将一定量的该盐溶于适量的水中。
(1)若测得溶液的pH为3,则该盐与水反应的离子方程式___________________________;
(2)若该 盐水溶液的pH为11,则其与水反应的离子方程式为_______________________;
盐水溶液的pH为11,则其与水反应的离子方程式为_______________________;
(8分)在FeCl3溶液中
(1)氯化铁水解的离子方程式为____________________________________________。
(2)在配制FeCl3溶液时,防止浑浊,应加 入________________________________。
入________________________________。
(3)在FeCl3溶液中加入一定量Na2CO3溶液,产生的现象是________________________,有关反应的离子方程式为_______________________________________________ _______。
_______。
已知某溶液只存在OH-、H+ 、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下关系:
①c(Cl-)> c(NH4+) > c(H+) > c(OH-) ②c(NH4+) > c(OH-) > c(Cl-)>c(H+)
③c(NH4+) > c(Cl-)> c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+) > c(OH-)
填写下列空白:
⑴若溶液中只有一种溶质,则该溶质是_________________,上述四种离子浓度的大小顺序(填序号)______________。
⑵若四种离子的关系符合③,则溶质为______________;若四种离子的关系符合④,则溶质为______________
⑶将pH相同的溶液稀释相同的倍数,下面图像正确的是(填图像序号)______________。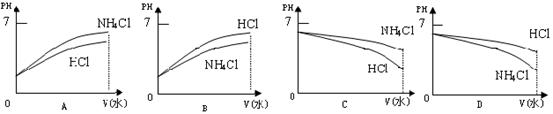
⑷若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O)(填“>”、“=”、“<”);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)_______c(OH-) (填“>”、“=”、“<”)。
实验室配制有0.1mol/L的Na2CO3溶液,根据电离平衡和水解知识,回答下列有关问题:
⑴写出H2CO3的电离方程式为 ;
⑵Na2CO3溶液显碱性,原因是(用离子方程式表示)
;(2分)
⑶在该溶液中,c(Na+)、c(CO32-) 、c(H+)、c(HCO3-)、c(OH-)的大小关系为
;(2分)
⑷根据电荷守恒原理,该溶液中离子浓度关系有:
c(Na+)+c(H+)= ;(2分)
⑸根据物料守恒原理,该溶液中离子浓度关系有:
c(Na+)= 。(2分)
(1)用热水配制AlCl3溶液,会出现浑浊现象,原因是(用离子方程式和必要的文字说明):
。要消除浑浊现象,又不污染药品,可加入适量的__________溶液。
(2)常温下,有①0.01 mol/L HCl溶液;②pH=12的氨水,其中水的电离程度① ②,(选填“>”、“<”或“=”);若将①、②混合后所得溶液pH=7,则消耗溶液的体积:① ②(选填“>”、“<”或“=”)。若用①来滴定未知浓度的氨水,通常选用____________作指示剂,达滴定终点时各离子浓度由大到小的顺序是_________________________________。
(3)某温度(T℃)时,测得0.01 mol·L-1NaOH溶液的pH=11,则在该温度下,将100 mL 0.2 mol·L-1的稀盐酸与100 mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= 。
试题篮
()