(17分)I.将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:
N2O4(g)  2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
(1)Tl℃时,40s~80s内用N2O4表示该反应的平均反应速率为_________________mol/(L·s)。
(2)△H___________O(填“>”、“<”或“=”)。
(3)改变条件重新达到平衡时,要使 的比值变小,可采取的措施有__________(填序号)。
的比值变小,可采取的措施有__________(填序号)。
a.增大N2O4的起始浓度 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
II.已知:常温下,HCN的电离常数为Ka=5×10-10。
(4)有浓度相同的HCN和NaCN的混合溶液。
①通过计算说明该溶液的酸碱性_____________________________________________。
②该溶液中各离子的浓度由大到小的顺序是___________________________________。
(5)常温下,向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性。
①该过程溶液中水的电离程度的变化为______________。
②若混合溶液中c(Na+)="a" mol/L,则c(HCN)=_________mol/L。
(18分)C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1;S(s)+O2=SO2(g) △H=-296.0 kJ·mol-1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:2 SO2 (g)+O2 (g) 2 SO3 (g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
2 SO3 (g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
(3)如图所示, A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为N2(g)+3H2(g)  2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。
①下列示意图正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是___。
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)=____。
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为_______ (用c1、c2、c3和>、<、=表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,则该温度下0.1 mol·L-1的NH4Cl溶液的pH为_________。
空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)一定条件下CO2可制得Na2CO3、NaHCO3等。
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者 后者(填“>”“<”或“=”)。
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,其中pH变化最大的是 (填字母编号)。
| A.Na2CO3 |
| B.NaHCO3 |
| C.NaAlO2 |
| D.CH3COONa |
E.NaOH
(2)已知反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
| 温度(℃) |
300 |
500 |
700 |
| K |
3.00 |
3.47 |
4.40 |
上述反应中a_______0(填“>”、“<”或“=”);在2L密闭容器中300℃下进行反应,若Fe和CO2的起始量均为4 mol,当达到平衡时CO2的转化率为________。
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气。下图为恒压容器中0.5 mol CO2和1.5 mol H2反应转化率达80%时的能量变化示意图。则该反应的热化学方程式为 。
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是制备HCOOH的示意图,根据要求回答问题: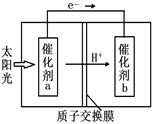
①催化剂b表面的电极反应式为 。
②经测定,若每分钟通过质子交换膜的H+的物质
的量为40mol,则每小时可产生O2 Kg。
对气体的转化与吸收的研究,有着实际意义。
(1)一定条件下,工业上可用CO或CO2与H2反应生成可再生能源甲醇,反应如下:
3H2(g)+CO2(g) CH3OH(g)+H2O(g) △H1=-49.0KJ/mol K1(Ⅰ)
CH3OH(g)+H2O(g) △H1=-49.0KJ/mol K1(Ⅰ)
2H2(g)+CO(g) CH3OH(g) △H2=-90.8KJ/mol K2(Ⅱ)
CH3OH(g) △H2=-90.8KJ/mol K2(Ⅱ)
则CO(g)+H2O(g) CO2(g)+H2(g)的△H3= KJ/mol和K3= (用K1和K2表示)
CO2(g)+H2(g)的△H3= KJ/mol和K3= (用K1和K2表示)
(2)在一定温度下,将0.2mol CO2和0.8mol H2充入容积为2L的密闭容器中合成CH3OH(g)。
5min达到平衡时c(H2O)=0.025mol/L,则5min内v(H2)= _______mol/(L·min)。下图图像正确且能表明该反应在第5min时一定处于平衡状态的是______。
若改变某一条件,达到新平衡后CO2的浓度增大,则下列说法正确的是_______。
a.逆反应速率一定增大 b.平衡一定向逆反应方向移动
c.平衡常数不变或减小 d.CO2的物质的量可能减小
(3)反应II可在高温时以ZnO为催化剂的条件下进行。实践证明反应体系中含少量的CO2有利于维持ZnO的量不变,原因是_________(写出相关的化学方程式并辅以必要的文字说明;已知高温下ZnO可与CO发生氧化还原反应)。
(4)实验室里C12可用NaOH溶液来吸收。室温下,若将一定量的C12缓缓通入0.2mol/L NaOH溶液中,恰好完全反应得溶液A,反应过程中水的电离程度________(填“变大”、“变小”或“不变”,下同), _________。溶液B为0.05mol/L的(NH4)2SO4溶液,则A、B两溶液中c(ClO-)、c(Cl-)、c(NH4+)、c(SO42-)由大到小的顺序为_________(已知:室温下HClO的电离常数Ka=3.2×10-8, NH3·H2O的电离常数Kb=1.78×10-5)。
_________。溶液B为0.05mol/L的(NH4)2SO4溶液,则A、B两溶液中c(ClO-)、c(Cl-)、c(NH4+)、c(SO42-)由大到小的顺序为_________(已知:室温下HClO的电离常数Ka=3.2×10-8, NH3·H2O的电离常数Kb=1.78×10-5)。
在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
(1)向体积均为20.00 mL、浓度均为0.1 mol·L-1盐酸和醋酸溶液中分别滴加0.1 mol·L-1 NaOH溶液。随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:
①用NaOH溶液滴定醋酸溶液的曲线是__________________(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是______________溶液(填化学式);
③图中V1和V2大小的比较:V1_____V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:
______>______>______>________(用离子的物质的量浓度符号填空)。
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:_____________(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为________(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=______________。
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:元素W的一种原子的原子核中没有中子;元素X 构成的某种单质在自然界中硬度最大;元素Z在地壳中含量最高。试回答下列各题:
(1)元素Z在周期表中的位置为 。
(2)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A和B是日常生活中常用调味品的主要成分,且A与B能够反应生成C,写出该反应的化学方程式 。
(3)由W、X、Y、Z四种元素中的三种元素组成中学化学常见的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式: 。
(4)W、Y、Z可组成离子化合物M,M的水溶液呈 (填“酸性”或“碱性”或“中性”),M溶液中各离子浓度由大到小的顺序为 ;W、Y、Z也可组成共价化合物N,M和N两种溶液的pH均为a,那么两溶液中由水电离出的c (H+)的比为 。
(5)已知由元素X和Z可组成A、B、C、D四种中学化学常见的单质或化合物,四种物质之间存在如图所示的转化关系。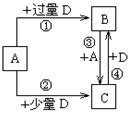
已知:298K时,反应①生成1mol B(g)时放出393.5 kJ热量,反应④生成1mol B(g)时放出283.0 kJ的热量,反应③的热化学方程式为 。
“2015.8.12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。已知部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 ( 25℃) |
Ki=1.77×10-4 |
Ki=5.0×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)根据价键规则,写出HCN的结构式是 ;
(2)下列能用于判断氮、碳两种元素非金属性强弱的是________。(填序号)
a.气态氢化物沸点
b.最高价氧化物对应水化物酸性强弱
c.Al2O3 + N2 + 3C ="=" 2AlN + 3CO
d.单质晶体类型
(3)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是 ;通过列式计算“c(CN-)与c(HCN)”的大小 判断:c(CN-) c(HCN)(填“>”、“<”或“=”)
(4)含CN﹣的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN﹣氧化成CNO﹣。CNO﹣在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN﹣被处理的百分率。
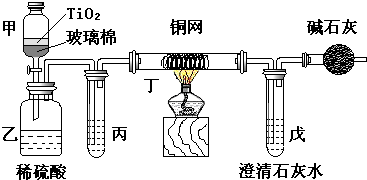
将浓缩后含CN﹣的废水与过量NaClO溶液的混合液(其中CN﹣浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为 ;乙中反应的离子方程式为 。
②乙中生成的气体除CO2、N2外还有HCl及副反应生成的Cl2等,上述实验是通过测定CO2的量来确定CN﹣的处理效果.丙中加入的除杂试剂是 (填标号)。
(A)饱和食盐 (B)饱和NaHCO3溶液 (C)浓NaOH溶液 (D)浓硫酸
丁在实验中的作用是 。戊中盛有足量的石灰水,若实验后戊中共生成0.8g沉淀,则该实验中CN﹣被处理的百分率 80%(填“>”、“二”或“<”=)。
铁及其化合物有着广泛用途。
(1)将饱和三氯化铁溶液滴加至沸水中可制取氢氧化铁胶体,写出制取氢氧化铁胶体的化学方程式 。
(2)含有Cr2O72-的废水有毒,对人畜造成极大的危害,可加入一定量的硫酸亚铁和硫酸使Cr2O72-转化为Cr3+,该反应的离子方程式为 。然后再加入碱调节溶液的pH在6-8 之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
(3)铁镍蓄电池又称爱迪生蓄电池,放电时的总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,充电时阳极附近的pH (填:降低、升高或不变),放电时负极的电极反应式为 。
(4)氧化铁是重要的工业原料,用废铁屑制备氧化铁流程如下: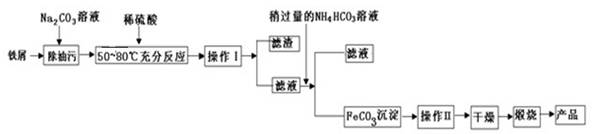
①铁屑溶于稀硫酸温度控制在50~800C的主要目的是 。
②写出在空气中煅烧FeCO3的化学方程式为 。
③FeCO3沉淀表面会吸附S042-,需要洗涤除去。
洗涤FeCO3沉淀的方法是 。
判断沉淀是否洗净的方法是 。
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式: 
(2)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为 。
(3)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表: 
上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= 。
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。
(4)CO2经常用氢氧化钠来吸收,现有0.4 molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在 650 ℃下工作的燃料电池,其负极反应式: 则
则
正极反应式:___ ,电池总反应式 。
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
①反应(I)的平衡常数表达式K=_______,若K= ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②反应(I)的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-): n ( HSO3-) |
91:9 |
1:1 |
1:91 |
| pH(25℃) |
8.2 |
7.2 |
6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为_________________________。
常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
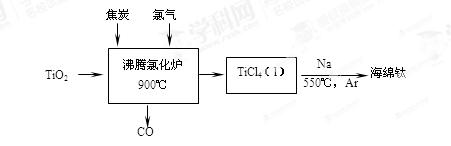
(1)TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
②Cl2含量检测仪工作原理如下图8,则Cl2在Pt电极放电的电极反应式为 。

③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3 + 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为 mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K= 。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如上图9所示,下列判断正确的是 (填序号)。
a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察上图10回答问题。催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(14分)氨是重要的化工原料,可以制尿素等多种产品
(1)合成氨所用的氢气可以甲烷为原料制得,有关化学反应的能量变化如下图所示。
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合亚铜溶液来吸收原料氕中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l)
[Cu(NH3)3]CH3COO·CO(l)  H<0,吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 (填写选项编号)。
H<0,吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 (填写选项编号)。
A.高温、高压 B.高温、低压
C.低温、低压 D.低温、高压
(3)氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0,某温度下,向容器为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。该温度下次反应的平衡常数K为 。
CO(NH2)2(l)+H2O(g) △H<0,某温度下,向容器为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。该温度下次反应的平衡常数K为 。
(4)取两个相同的恒容容器,保持相同温度,并加入等量的CO2气体,根据实验数据绘制出(NH3)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则____(填“A”或“B”)曲线所对应的实验温度高,判断的依据是 。
(5)已知某些弱电解质在水中的电离平衡常数(25 ℃)如下表:
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+ )>c(CO32-)>c(HCO3- )>c(NH3·H2O)
B.c(NH4+ )+c(H+)=c(HCO3- )>c(OH-)+ c(CO32-)
C.c(HCO3- )+c(H2CO3)+ c(CO32-)="0.1" mol·L-1
D.c(NH4+ )+c(NH3·H2O)=2c(CO32-)>2c(HCO3- )+ 2c(H2CO3)
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g)ΔH="+108" kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g)ΔH="+108" kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出):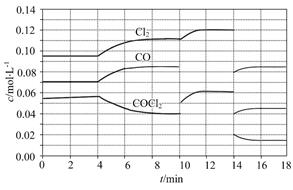
①计算反应在第8 min时的平衡常数K= ;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·L-1;
④比较产物CO在2 min~3 min、5 min~6 min和12 min~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小 ;
⑤比较反应物COCl2在5 min~6 min和15 min~16 min时平均反应速率的大小:v(5~6) v(15~16)(填“<”、“>”或“=”),原因是 。
(2)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断 (NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a、NH4HCO3 b、NH4A c、(NH4)2CO3 d、NH4Cl
(本题共14分)火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害。对烟气中CO2、CO、SO2等物质进行回收利用意义重大。
(1)“湿式吸收法”利用吸收剂与烟气中的SO2发生反应从而脱硫,其中“钠碱法”用NaOH溶液作吸收剂,向100mL2mol·L-1的NaOH溶液中通入标准状况下4.48LSO2气体,反应后测得溶液pH<7.则溶液中下列各离子浓度关系正确的是 (填字母序号).
a.c(HSO3-)>c(SO32-)>c(H2SO3)
b.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
d.c(H+)= c(SO32-)- c(H2SO3)+c(OH-)
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示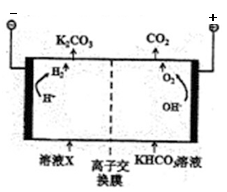
①在阳极区发生的反应中的非氧化还原反应的离子方程式为 .
②简述CO32-在阴极区再生的原理 .
(3)下表中列出了25℃、l0l kPa时一些物质的燃烧热数据:
已知键能:C—H键:413.4kJ.mol-l. H—H键:436.0 kJ·mol-1,请计算:
①2CH4(g)=C2H2(g)+3H2(g) △H=
②C2H2中—C≡C—的键能为 kJ·mol-l
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。负极反应式为 .为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,为此电池工作时必须有部分A物质参加循环,则A物质的化学式是 .
已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离于浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填编号)。
(2)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好反应,则混合前两溶液的物质的量浓度大小关系为c(NaOH) c(CH3COOH)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是c(H+) c(OH-)。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好是中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH) c(CH3COOH)(填“大于”“小于”或“等于”),混合后溶液中的各离子浓度的大小关系为
试题篮
()