(10分)现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A溶液、B溶液、C溶液、D溶液进行实验。实验过程和记录如图所示(无关物质已经略去):
请回答:
(1)Y、Z的化学式分别为:Y________;Z__________。
X与B反应的离子方程式为_________________________________________________。
(2)D溶液pH________7(填“大于”“小于”或“等于”),原因是(用离子方程式表示)____________。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是__________________。(用化学式表示)
(4)请写出C与过量B反应(加热)的离子方程式______________________。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是___________。
(14分)某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图。
材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物。如:
2NH3 + 3CuO 3Cu + N2 +3H2O
3Cu + N2 +3H2O
材料2:Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成:Cu2+和Cu:Cu2O + 2H+ ="=" Cu2+ + Cu +H2O
请回答下列问题:
(1)在实验室里,该学习小组设计下列制取纯净干燥氨气的方案,简易、可行的最佳方案是 。
| A.加热氯化铵固体,再通过碱石灰 |
| B.在N2和H2的混合气体中加入铁触媒,并加热至500℃,再通过碱石灰 |
| C.加热浓氨水,再通过碱石灰 |
| D.在生石灰中加入浓氨水,再通过浓硫酸 |
(2)为证明NH3 还原CuO的反应中有水生成,B中应放入的试剂是 。
(3)当观察到 (填现象),即表明A中的反应已经完成。
(4)该小组欲用体积比为1︰4的稀硫酸做试剂,检验反应是否有Cu2O固体生成。现用98%的浓硫酸配制1︰4的稀硫酸,所需的玻璃仪器除了胶头滴管外还有 。
可证明还原产物中含有Cu2O的操作及现象是 。
(5)请写出A中生成Cu2O的化学方程式 。
(6)若用定量的方法测定该反应是否生成Cu2O,最简便且准确的方法是 。
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解).
(1)实验原理:①Al4C3与硫酸反应可生成CH4.②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与过量NaOH溶液反应的化学方程式_____________________________。
(2)实验装置(如图所示):
(3)实验过程:
①连接实验装置,检验装置的气密性.称得D装置的质量为yg,滴定管的读数为amL。
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应。
③待反应进行完全后,关闭活塞___________,打开活塞____________,通过分液漏斗加入过量________(填化学式),与装置B瓶内物质充分反应。
④_____________(填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L•mol-1)
①Al4C3的质量分数为___________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
③AlN的质量分数为_______________。
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答:
(1)写出A中反应的离子方程式 。
(2)B装置中所盛试剂是 ;E中烧杯内冷水的作用是 。
(3)实验前玻璃管之间连接需要用到橡皮管,其连接方法是:先把 ,然后稍稍用力即可把玻璃管插入橡皮管中。
(4)检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。其中通入干燥CO2的目的是 。
(5)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过 (填实验名称)即可得到较纯净的PCl3。
(6)实验后关闭K1,打开K2,将A、B中余氯通入300ml 1mol/L的NaOH溶液中。若NaOH恰好完全反应,则吸收氯气的物质的量为(假设反应生成了NaCl 、 NaClO 和 NaClO3等钠盐) mol,反应中转移电子的物质的量(n)的范围是 。
【改编】(15分)氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g) + CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0

(1)如用图1装置制取氨气,你所选择的试剂是 。制备氨基甲酸铵的装置如图3所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
(2)发生器用冰水冷却的原因是 。
(3)液体石蜡鼓泡瓶的作用是 。
(4)从反应后的混合物中分离出产品的实验方法是 (填写操作名称);为了得到干燥产品,应采取的方法是 (填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40℃以下烘干
(5)尾气处理装置如图2所示。双通玻璃管的作用 ;浓硫酸的作用 。
(6)称取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g。则样品中氨基甲酸铵的物质的量分数为 。(精确到2位小数)
(2014届甘肃河西五市部分普通高中高三第一次联合考试化学试卷)
图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。

(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先___ _____,在E中装入水,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生________(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________________________。
(4)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:____________________,迅速产生倒吸的原因是____________________________。
下图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。

(1)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞:
① 锥形瓶内产生的气体主要有(写化学式) 。
② 用产生的气体做氨的催化氧化实验,各仪器装置按气流方向从左到右连接顺序是(填字母)( )→( )→( )→E
③试管B中的现象为 ,反应方程式为 。
(2)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是CuO、无水CuSO4粉末。
①此实验的目的是 ,
D装置的作用是 。
②为了使B中CuO反应充分,在不改变现有药品的条件下,可采取的方法有 。(写出一种即可)
③加热前必须进行的操作是 。
某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是__________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是______________________。
再由a向c中加2mL蒸馏水,c中的实验现象是_____________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____,理由是_______。
| 方案 |
反应物 |
| 甲 |
Cu、浓硝酸 |
| 乙 |
Cu、稀硝酸 |
| 丙 |
Cu、O2、稀硝酸 |
(4)该小组同学向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸。观察到的实验现象是_________;该小组同学实验目的是_________,但此实验的不足之处是_____________________。
亚硝酸钠在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略)。
已知:
①3NaNO2+3HCl 3NaCl+HNO3+2NO↑+H2O
3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO或 都能与
都能与 反应生成
反应生成 和Mn2+;
和Mn2+;
完成下列填空:
(1)写出a仪器的名称________________。
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为_________________。
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式______________;当该反应中转移0.1mol e-时,理论上吸收标准状况下NO的体积为___________L。
(4)D装置中发生反应的离子方程式为_____________________。
(5)将11.7g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭_____________g。
掌握物质之间的转化,是学习元素化合物知识的基础。
(1)中学常见的某反应的化学方程式为:A+B→C+D+H2O(未配平,反应条件略去)。
若C、D均为气体,且都能使澄清石灰水变浑浊。
①请写出该反应的化学方程式 ;
②某探究性学习小组利用图中所列装置实验,证明上述反应中有C、D生成。则a瓶对应的现象是 ,b瓶溶液还可以用 代替。
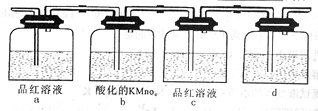
③装置d中所盛溶液是 。
(2)为研究硝酸置于适量的浓HNO3和稀HNO3中(如下图所示)。
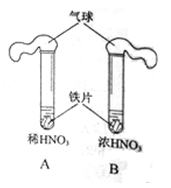
①气球的作用是 。
②A中,最终溶液变为浅绿色,发生反应的离子方程式是 。
③B中,无明显变化,该同学进一步探究如下:
假设:Ⅰ常温下铁与浓硝酸不反应。
Ⅱ 。
进行实验,将B中的铁片取出并洗净后,放入CuSO4溶液中,无明显变化,则说明假设Ⅰ (填“成立”或“不成立”)。
某学习小组利用下图所示装置制备氨气,并探究氨气的性质(部分仪器略去)。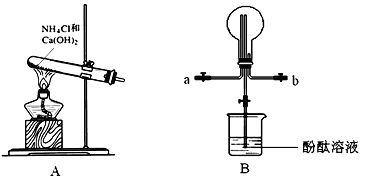
请回答下列问题:
(1)写出以A装置制备氨气的化学方程式:__________________
(2)用B装置收集氨气时,氨气的进气口是__________(填“a”或“b”)。
(3)B装置中烧瓶已收集满氨气,若要使之形成喷泉,操作方法是__________。若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_________(填序号)。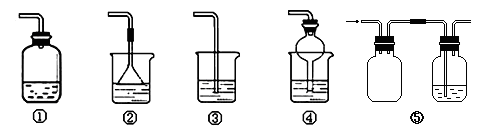
(5)氨气在催化剂并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式:_________。
某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验:
(Ⅰ)NH3的制取及收集
1.写出实验制取氨气的化学方程式 ;
2.收集氨气
(II)HCl的制取及收集
实验室通常以反应:2NaCl(晶体)+H2SO4(浓) Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
1.实验室制取HCl气体可选择下列装置中的( )
A.实验室制氧气的装置 B.实验室制氢气的装置
C.实验室制二氧化碳的装置 D.实验室制氯气的装置
2.实验室制取HCl气体的反应原理遵循了以下化学反应规律中的( )
A.氧化还原反应原理
B.强酸制弱酸原理
C.难挥发性酸制取易挥发性酸
D.复分解反应原理
(III)验证氨气部分性质的探究实验:
为了同时进行氨气溶于水以及氨气与HCl的反应的探究,同学们设计了如下的实验装置图。首先在甲、乙两个干燥的圆底烧瓶中分别收集满了NH3和HCl气体,然后再按如下图所示连接好各个装置(活塞a和b均处于关闭状态),并按以下步骤进行实验:
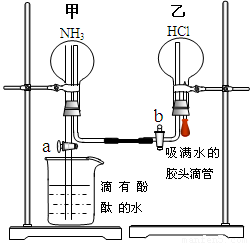
1.先挤压胶头滴管再打开活塞b,请你预测此时乙中可能观察到的现象是: ______ 。
发生反应的方程式为: 。
2.待乙中观察到明显现象后立即关闭活塞b,并打开活塞a,又将可能观察到的实验现象是: 。
某化学小组按下图所示实验流程比较浓硝酸和稀硝酸的氧化性强弱,其中B为一种紫红色金属,C为红棕色气体。

请回答下列问题:
(1)A与B反应的化学方程式是 ;A与B反应迅速,实验中需要采取措施控制气体放出的快慢,则装置Ⅰ所选择的主要仪器为 (不包括铁架台、铁夹、橡皮塞和导管等)。
(2)实验时在装置Ⅰ中加入B后,在加入A之前需向整套装置中通入足量的CO2气体,该操作的目的是 。实验室制取CO2气体的化学方程式是 。
(3)装置Ⅱ中发生反应的化学方程式是 。
(4)通过实验可得出:浓硝酸的氧化性比稀硝酸 (填“强”或“弱”),判断的依据 是 。
(5)小组内有同学指出该流程中装置Ⅴ可有可无,你认为装置Ⅴ是否需要 (填“是”或“否”),理由是 。
(10分)垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下:
(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:__________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
| A.铜粉 | B.氨水 | C.氢氧化铜 | D.碳酸铜 |
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=____________,此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为_______________。
亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)
查阅资料:
①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
(1)A中反应的化学方程式是 。
(2)B中观察的主要现象是 ,D装置的作用是 。
(3)经检验C产物中亚硝酸钠含量较少。
a.甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。生成碳酸钠的化学方程式是 。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是 (写名称)。
b.乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 。
试题篮
()