某化学课外活动小组在实验室设计了如图所示的实验装置,进行“氨的催化氧化”实验。
(1)A处是气体发生装置,A中所用的试剂只能从下列物质中选取:
①硝酸铵;②碳酸铵;③碳酸氢铵;④氯化铵;⑤熟石灰;⑥氢氧化钠。
若A中制取气体时只用了一种药品,则该药品可以是 (填选项编号),在只用一种药品制取氨气时,图中空白处所需仪器应为 (选填下列仪器编号,固定装置省略)。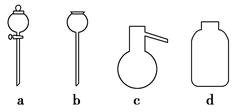
(2)该装置补充完整后,仍然存在一定的缺陷,试从安全与环保的角度来考虑,对该装置进行改进:
① ;
② 。
(3)按照改进后的装置进行实验,请完成以下问题:
①装置B的作用是 ;
②写出C中发生反应的化学方程式: ;
③若A、B处试剂足量,则装置D中可以观察到的实验现象有 。
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式:______________________________________。
(2)装置A中的烧瓶内固体可选用_________(选填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B ,D_____________,E 。(均填编号)
(4)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出该反应的化学方程式: ;该反应中每生成0.5molN2转移 mol电子。
下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略.

(一)甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现.
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学反应方程式是:__________,C装置中盛放的液体药品的名称是______________。
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察__________得知.
(3)本实验在设计上_________(填有、无)缺失之处?若有请给出改进方案。(若无,此问可不答)
(二)乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅.
(4)写出乙同学认为的D装置中发生反应的化学方程式_________________________________。
(5)对于A处,乙认为不需加热装置。则A处仪器中分别放置的药品为:分液漏斗中____________圆底烧瓶中_________
(6)若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基本一致,那么C处的广口瓶应改为__________所装药品为_____________。
己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
回答下列问题:
(1)A中生成氨气反应的化学方程式是 _________________;
(2)B中加入的干燥剂是_______(填序号)①浓硫酸②无水氯化钙③碱石灰;
(3)能证明氨与氧化铜反应的现象:①C中______、②D中有无色液体生成;
设计实验检验D中无色液含有水:取少量液体于试管中,加入少量_______粉末,现象为______。
(4)写出氨气与氧化铜反应的化学方程式 _______________。若收集到2.24L(STP)氮气,计算转移电子数为______________。
制备氮化镁的装置示意图如下:
回答下列问题:
(1)检查装置气密性的方法是__________________________,
a的名称是________,b的名称是________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式________________________________。
(3)C的作用是________,D的作用是________,是否可以把C与D的位置对调并说明理由________。
(4)写出E中发生反应的化学方程式____________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象___________________________________
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下两种实验方案。
已知:① AlN + NaOH + H2O=NaAlO2 + NH3↑
② NH3极易溶于水,难溶于四氯化碳和苯。
【方案1】用下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
(1)为测定生成气体的体积,量气装置中的X液体可以是_______。
a.CCl4 b.H2O
c.NH4Cl溶液 d.苯
(2)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是___________。(用含m和V的代数式表达)
【方案2】按以下步骤测定样品中A1N的纯度:
(3)步骤①的化学方程式为AlN + NaOH + H2O=NaAlO2 + NH3↑和___________________。
(4)在步骤③中洗涤沉淀的方法是_____________________________________,若未洗涤,则测定结果将________(填“偏高”、“偏低”或“无影响”)。
(5)样品中AlN的质量分数是___________。(用含m1和m2的代数式表达)
为探究铜与稀硝酸反应产生的气体主要是NO,某课外活动小组设计了下列实验。图中D为止水夹,F是装有一半空气的注射器,其中加热装置和固定装置均已略去。
请回答有关问题:
(1)组装好装置后,关闭D,若装置的气密性良好,向外抽注射器活塞,C装置中有什么现象?
;
(2)反应开始前要向体系中通入气体A,为什么? ;A可以是 (填序号) ①N2 ②O2 ③空气 ④CO2
(3)当完成装置A的实验目的后,关闭D,再将装置B中的铜丝插入稀硝酸。B中反应的离子方程式是: 。
(4)反应一段时间后,将F中空气推入E中,证明生成了NO实验现象是: 。
(5)装置C的作用是: 。
Ⅰ.实验室可用下图所示装置制取氨,再用氨与氧化铜反应以检验氨的某些性质(最后C装置中氧化铜变成铜, 且导管排出的是氮气和水蒸汽)。

(1)写出A中反应的化学方程式:___________________
(2)写出C中反应的化学方程式:___________________此反应中氨表现出_______性。
(3)B中盛装的固体是______________,其作用是___________________
(4)停止实验时,应先撤______装置中的酒精灯(填“A”或“C”)。
Ⅱ.工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别。路线①②③是工业生产硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。

(1)完成下列反应的化学方程式:
写出①的化学方程式:__________________;写出Ⅲ的化学方程式:__________________;
(2)下列环境问题与NO2的排放有关的是_______(填字母序号)
A 赤潮 B 光化学烟雾 C 臭氧空洞 D 温室效应 E 酸雨
氮的循环涉及到多种化学物质。(下图中的W、M、X、Y、Z均是化学物质)
(1)由N2→X是工业合成氨的反应,写出其化学方程式 。
(2)写出Y、M的化学式 、 。
(3)X可与HNO3反应,产物可用作氮肥,写出X与HNO3反应的化学方程式 。
(4)某同学利用下图装置将氨气与氧化铜反应,验证氨气的性质并验证部分产物(部分未画出)
发现反应确实能发生,且反应后得到三种物质,其中有两种单质。
请回答下列问题:
① 实验室制取氨气的化学方程式是 。
② 从氨中N元素的化合价角度看,该同学想证明的是氨的 性质,实验中观察到的 现象则能够证明氨具有这个性质。
③B装置的作用是 。
④A中反应的化学方程式是 。
掌握物质之间的转化,是学习元素化合物知识的基础。
(1)中学常见的某反应的化学方程式为:A+B→C+D+H2O(未配平,反应条件略去)。
若C、D均为气体,且都能使澄清石灰水变浑浊。
①请写出该反应的化学方程式 ;
②某探究性学习小组利用图中所列装置实验,证明上述反应中有C、D生成。则a瓶对应的现象是 ,b瓶溶液还可以用 代替。
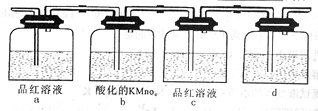
③装置d中所盛溶液是 。
(2)为研究硝酸置于适量的浓HNO3和稀HNO3中(如下图所示)。
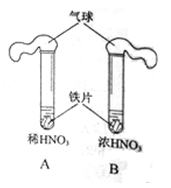
①气球的作用是 。
②A中,最终溶液变为浅绿色,发生反应的离子方程式是 。
③B中,无明显变化,该同学进一步探究如下:
假设:Ⅰ常温下铁与浓硝酸不反应。
Ⅱ 。
进行实验,将B中的铁片取出并洗净后,放入CuSO4溶液中,无明显变化,则说明假设Ⅰ (填“成立”或“不成立”)。
某学习小组利用下图所示装置制备氨气,并探究氨气的性质(部分仪器略去)。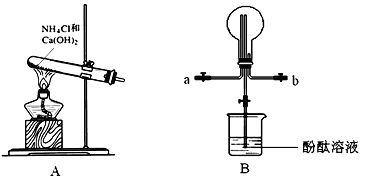
请回答下列问题:
(1)写出以A装置制备氨气的化学方程式:__________________
(2)用B装置收集氨气时,氨气的进气口是__________(填“a”或“b”)。
(3)B装置中烧瓶已收集满氨气,若要使之形成喷泉,操作方法是__________。若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_________(填序号)。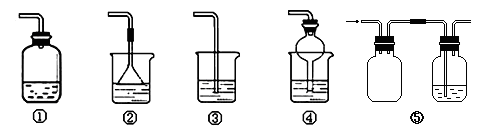
(5)氨气在催化剂并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式:_________。
某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验:
(Ⅰ)NH3的制取及收集
1.写出实验制取氨气的化学方程式 ;
2.收集氨气
(II)HCl的制取及收集
实验室通常以反应:2NaCl(晶体)+H2SO4(浓) Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
1.实验室制取HCl气体可选择下列装置中的( )
A.实验室制氧气的装置 B.实验室制氢气的装置
C.实验室制二氧化碳的装置 D.实验室制氯气的装置
2.实验室制取HCl气体的反应原理遵循了以下化学反应规律中的( )
A.氧化还原反应原理
B.强酸制弱酸原理
C.难挥发性酸制取易挥发性酸
D.复分解反应原理
(III)验证氨气部分性质的探究实验:
为了同时进行氨气溶于水以及氨气与HCl的反应的探究,同学们设计了如下的实验装置图。首先在甲、乙两个干燥的圆底烧瓶中分别收集满了NH3和HCl气体,然后再按如下图所示连接好各个装置(活塞a和b均处于关闭状态),并按以下步骤进行实验:
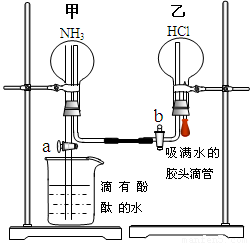
1.先挤压胶头滴管再打开活塞b,请你预测此时乙中可能观察到的现象是: ______ 。
发生反应的方程式为: 。
2.待乙中观察到明显现象后立即关闭活塞b,并打开活塞a,又将可能观察到的实验现象是: 。
某化学小组按下图所示实验流程比较浓硝酸和稀硝酸的氧化性强弱,其中B为一种紫红色金属,C为红棕色气体。

请回答下列问题:
(1)A与B反应的化学方程式是 ;A与B反应迅速,实验中需要采取措施控制气体放出的快慢,则装置Ⅰ所选择的主要仪器为 (不包括铁架台、铁夹、橡皮塞和导管等)。
(2)实验时在装置Ⅰ中加入B后,在加入A之前需向整套装置中通入足量的CO2气体,该操作的目的是 。实验室制取CO2气体的化学方程式是 。
(3)装置Ⅱ中发生反应的化学方程式是 。
(4)通过实验可得出:浓硝酸的氧化性比稀硝酸 (填“强”或“弱”),判断的依据 是 。
(5)小组内有同学指出该流程中装置Ⅴ可有可无,你认为装置Ⅴ是否需要 (填“是”或“否”),理由是 。
(10分)垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下:
(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:__________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
| A.铜粉 | B.氨水 | C.氢氧化铜 | D.碳酸铜 |
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=____________,此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为_______________。
亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)
查阅资料:
①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
(1)A中反应的化学方程式是 。
(2)B中观察的主要现象是 ,D装置的作用是 。
(3)经检验C产物中亚硝酸钠含量较少。
a.甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。生成碳酸钠的化学方程式是 。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是 (写名称)。
b.乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 。
试题篮
()