某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol/L的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是: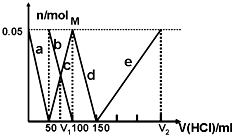
| A.原混合溶液中的CO2-3与AlO-2的物质的量之比为1:2 |
| B.V1:V2=1:5 |
| C.M点时生成的CO2为0.05mol |
| D.a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓ |
已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是
(甲)XO3n+Xn+H+--X单质+H2O(未配平);(乙)Mm++mOH-→M(OH)m↓
①若n=1,则XO3n中X元素为+5价,X位于周期表第VA族
②若n=2.则X最高价氧化物的水化物可能与它的氢化物反应
③若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
④若m=3,则MCl3与氢氧化钠溶液互滴时的现象可能不同
| A.②③ | B.②④ | C.①② | D.①③ |
一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,乙是
| A.HCl | B.FeCl2 | C.KOH | D.NaHCO3 |
将2aL Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,其中一份加入b mol BaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c mol NH3,则原混合溶液中的Al3+离子浓度(mol/L)为( )
A. |
B. |
C. |
D. |
下图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。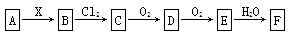
下列说法中不正确的是
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
铜放入稀硫酸中,再加入硝酸钠固体 |
开始无明显现象,后溶液变蓝,有气泡放出,铜溶解 |
硝酸钠可以加快铜与稀硫酸的反应速率 |
| B |
在KIO3溶液中加入HI溶液,并加入淀粉 |
溶液变成蓝色 |
KIO3的氧化性比I2强 |
| C |
向CH2=CHCH2OH中滴入酸性高锰酸钾溶液 |
紫红色褪去 |
证明CH2=CHCH2OH中含有碳碳双键 |
| D |
向Na2S溶液中加入酚酞,再滴加稀盐酸 |
溶液先变红,后红色变浅直至消失 |
证明非金属性:Cl>S |
根据下图海水综合利用的工业流程图,判断下列说法正确的是
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 |
| D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液( )
| A.可能呈酸性 | B.可能呈中性 | C.一定呈碱性 | D.一定呈中性 |
下列实验操作能达到目的的是
| A.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
| B.制取二氧化氮时,用水或NaOH溶液吸收尾气 |
| C.为测定Na2CO3和NaHCO3混合物中Na2CO3质量分数,取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g,该方案可行。 |
| D.为测定镀锌铁皮的锌层厚度,将镀锌铁皮与足量盐酸反应待气泡明显减少时取出, |
洗涤,烘干,称重。若烘干时间过长,会导致测定结果偏小。
有50mL某气体,可能含有CO2、O2、NH3中的一种或几种,将其通过浓H2SO4没有发现体积变化。通过足量Na2O2后,体积变为30mL,则该气体可能为( )
| A.CO2为20mL,NH3为30mL | B.NH3为40mL,O2为10mL |
| C.CO2为30mL,O2为20mL | D.CO2为40mL,O2为10mL |
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如下图所示(部分产物略去),则下列有关物质的推断不正确的是
A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是AlCl3溶液,E可能是氨水
D.若A是NaOH溶液,E是CO2,则B为NaHCO3
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3 b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4 d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,用化学方程式解释该方法的目的: ;若按以上方案:NO与O2循环通入反应池处理该矿石2.36103 kg,得到滤渣1.2103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
根据下图海水综合应用的工业流程图,判断下列说法正确的是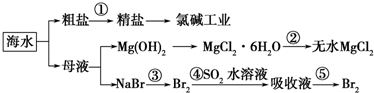
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等
| A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 |
| B.在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2 |
| C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
| D.从第③步到第⑤步的目的是为了浓缩富集溴 |
试题篮
()