中学常见反应的化学方程式有A+B→X+Y+H2O或H2O+A+B→X+Y(未配平,反应条件略去),下列问题所涉及反应是上述两个方程式之一。请回答:
(1)常温下,若A为黄绿色气体,B为非金属氧化物,A、B均能使品红溶液褪色,A+B+H2O→X+Y,且相对分子质量X>Y,则该反应的化学方程式________________,检验Y中阴离子的试剂是________________。
(2)若A为常见的金属单质,Y为气态单质,B溶液呈强酸性或强碱性时,A和B反应都能进行。写出A与B反应的离子方程式: ;
。
(3)若A为常见的非金属单质,它是构成有机物的基本元素之一,B的溶液为某浓酸,其中A、B的物质的量之比为1∶4,则该反应化学方程式为 。
(4)若A、B均为化合物,Y为白色沉淀(不含金属元素),B为引起温室效应的主要气体,写出A与B反应生成Y的离子方程式 。
已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机、轮船等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;G为液体。有关物质间的转化关系如下(图中部分反应物或产物已省略):
请填空
(1)B的电子式 ,B物质的水溶液呈 ,原因是 (用离子方程式表示)
(2)反应①的离子反应方程式为
(3)操作a必须在HCl气流中加热得无水物,其原因是 ;操作b为
(4)K+G+F→L写出该反应的化学方程式 ,
(5)已知C的燃烧热为286KJ/mol,请写出表示1g C在F中完全燃烧生成液体G的热化学反应方程式 。
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下图(图中部分产物未列出):
请填写下列空白:
(1)A是 ,G是 。(用化学式填写)
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液的反应生成I和D的离子方程式是 。
(5)向H溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,但该反应中没有放出E气体,则该反应的离子方程式 。
(6)将2.5 g H、I和碳酸氢钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:则物质I的物质的量为_______________mol。
由短周期元素组成的中学常见物质A、B、C、D、E存在右图转化关系(部分生成物和反应条件略)。
(1)若反应①在常温下进行,且E有漂白、杀菌作用,C是造成温室效应的主要气体,则:
E的电离方程式为 ,反应③的离子反应方程式为 。
(2)若反应①是重要的工业反应之一, X是生产生活中使用最广泛的金属,则:
a.若B为气体单质,反应①的化学反应方程式为 。
b.若E为非金属氧化物,C的化学式为 。
(3)若A分子含有4个碳原子,D、E是同种有机物,75% B的水溶液常用于医疗消毒,则:反应①的化学反应方程式为 。
(4)若A由两种元素构成,B为气体,E为白色沉淀,B、E都能使酚酞试液变红,则:反应①的化学反应方程式为 。
下图是中学化学中常见物质间的转化关系。其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体且1 mol E中含有 10 mol电子。乙和丁为黑色固体,将它们混和加热后发现固体由黑色变为红色。
(1)写出化学式:甲_________ ;
乙________;丙_______;
(2)丁的摩尔质量为 。
(3)写出丙和E反应生成A和B的化学方程式: 。
(4)有学生将乙和丁混和加热后收集到标准状况下气体8.96 L ,测得该气体对氢气的相对密度为16,若将气体通入足量的澄清石灰水中,得到白色沉淀物 g。
处理含氰电镀废水时,可在催化剂TiO2作用下,先用NaC1O将CN-离子氧化成CNO—,再在酸性条件下继续:NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置模拟上述实验,并测定CN-被处理的百分率。将浓缩后含CN—离子的污水与过NaClO溶液的混合液共200mL(其CN—的浓度为0.05mol·L—1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
回答下列问题:
(1)乙中生成气体N2和CO2外,还有副产物HCl及C12等,上述实验是通过测定二氧化碳的量来确定对CN—的处理效果,据此完成下列问题。
①丙中加入的除杂试剂是 (填字母)
A.饱和食盐水 B饱和NaHCO3溶液 C.浓NaOH溶液 D.浓硫酸
②丁在实验中的作用是
(2)装有碱石灰的干燥管的作用是 。
(3)戊中盛有含Ca(OH)2 0.02mol的石灰水:若实验中戊中生成0.82g沉淀,则该实验中测得CN—被处理的百分率等于 。若该测得值与实际处理的百分率相比偏低,请简要说明可能的任意一个原因 。
甲、乙两同学欲分别完成“钠与氯气反应”的实验。
Ⅰ.甲同学的方案为:取一块绿豆大的金属钠(除去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶抽去玻璃片后倒扣在钠的上方(装置如图Ⅰ)。该方案的不足之处有 。
Ⅱ.乙同学所采用的装置如图Ⅱ,回答下列问题:
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为 ;待整套装置中 后,点燃酒精灯。
(2)点燃酒精灯后,玻璃管中出现的现象是 。
(3)乙同学欲将虚框内装置改为图Ⅲ所示装置,并测量多余气体的体积。
①为提高测量的准确性,图Ⅲ量气管装置中的液体可用 ;收集完气体后并读数,读数前应进行的操作是冷却至室温并 。
②若未冷却至室温立即按上述操作读数,则会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)
③如果开始读数时操作正确,最后读数时俯视右边量气管液面,会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
I.硝酸铜在1000℃时分解:Cu(NO3)2=Cu+2NO2↑+O2,用试管收集一试管气体并倒立于盛水的水槽中,观察到的现象是 ,若溶质不扩散,试管内溶液中溶质的物质的量浓度是 (假设在标准状况下)。
II.工业上生产硝酸铜晶体的流程图如下:
①若保温去铁反应生成气体是NO时,则离子方程式是 。
②蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是 (结合离子方程式说明)。
③如图所示为硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),从图中获取如下信息,不正确的有 (填字母)。
a.C点溶液为Cu(NO3)2的不饱和溶液
b.30℃时结晶可析出两种晶体
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.将A点溶液升温至30℃时,可以析出Cu(NO3)2·3H2O晶体
④某些共价化合物(如H2O、NH3、N2O4等)在液态时发生了微弱的电离,如:2H2O OH—+H3O+, 则液态NH3电离的方程式是 ,液态N2O4电离得到电子数相差18的阴阳离子,因此可用Cu与液态N2O4反应制备无水硝酸铜,其反应的化学方程式是 。
OH—+H3O+, 则液态NH3电离的方程式是 ,液态N2O4电离得到电子数相差18的阴阳离子,因此可用Cu与液态N2O4反应制备无水硝酸铜,其反应的化学方程式是 。
工业上常以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)已知将MnO2、ZnS浸在硫酸溶液中有少量黄色物质析出,写出并配平该化学反应方程式: 。
(2)在酸浸的过程中还会发生以下反应:
a.3MnO2 +2FeS +6H2SO4=3MnSO4 +Fe2(SO4)3+2S+ 6H2O
b.MnO2+CuS+4H2SO4=MnSO4+CuSO4+S+2H2O
c.Al2O3+3H2SO4=Al2(SO4)3+3H2O
将酸浸所得的酸性溶液按以下的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn。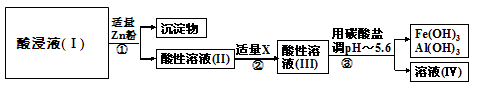
①操作①中加Zn粉后发生反应的离子方程式为:Zn+2H+=Zn2++H2↑、Zn+Cu2+=Zn2++Cu、 。
②操作②中加入适量X的作用是: 。
③操作③中所加碳酸盐的化学式是: 。
(3)为了从上述流程中产生的Fe(OH)3 、Al(OH)3沉淀混合物中回收Al(OH)3,某化学兴趣小组设计了如下两种方案图。
方案Ⅰ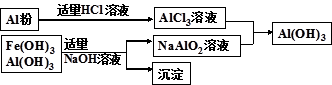
方案Ⅱ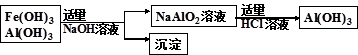
①方案Ⅰ中,AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为: 。
②从消耗酸碱的用量角度考虑,方案 (填“Ⅰ”或“Ⅱ”)所消耗的酸碱少些。
溴被称为“海洋元素”,海水中的溴主要以NaBr的形式存在。查阅资料得知:Br2的沸点为59℃,微溶于水,易溶于有机溶剂。实验室简单模拟从海水(此处以低浓度的NaBr溶液代替)中提取溴单质的流程如图: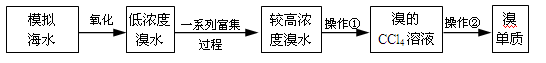
(1)写出实验操作的名称,操作① 、操作② ;
(2)在富集过程中,有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是
A.2NaBr+Cl2 = 2NaCl+Br2
B.2H2S+SO2 = 2H2O+3S↓
C.AlCl3+3NaAlO2+6H2O = 4Al(OH)3↓+3NaCl
D.Cl2 + 2NaOH =" NaCl" +NaClO + H2O
(3)实验前检测分液漏斗没有问题,但在操作①的步骤中,旋开分液漏斗下端的旋塞,却发现分液漏斗中的液体很难滴下,其原因是 ;
(4)下列说法正确的是 。
A.操作①中,可以用酒精代替CCl4
B.操作②中,若发现忘了加碎瓷片,应该趁热补加
C.操作②中,温度计水银球应浸没在蒸馏烧瓶中液体的液面以下,但不能接触瓶底
D.操作②中,冷凝水流向应该是下进上出
蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁实验步骤如下:
已知:
| 氢氧化物 |
Fe(OH) 3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
1.5 |
3.3 |
9.4 |
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的阳离子有 。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解、 沉淀。
(3)物质循环使用,能节约资源上述实验中,可以循环使用的物质是 。
(4)高温煅烧碱式碳酸镁aMgCO3·bMg(OH)2·cH2O得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式为 。(写出计算过程,否则不得分)
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。
(1)酸浸时反应的化学方程式为 ;滤渣I的主要成分为 (填化学式)。
(2)滤渣Ⅱ的主要成分为 (填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为 。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2 = Al(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为 ;氧化后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验。取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤,滤液中通入过量二氧化碳,请写出通入过量二氧化碳反应的离子方程式是___________,______________。
Ⅱ.牙膏样品中碳酸钙的定量测定。利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C 中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(2)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有_________________
(3)C中反应生成BaCO3的化学方程式是_____________________________________
(4)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为______。
(6)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是________。
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·H2O),过程如下:
请回答下列问题:
(1)写出过程①中FeS和O2、H2SO4反应的化学方程式: 。
(2)将过程②中产生的气体通入下列溶液中,溶液会腿色的是 。
| A.品红溶液 | B.紫色石蕊试液 | C.酸性高锰酸钾溶液 | D.溴水 |
(3)过程③中,需要加入的物质是 (化学式)。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有 。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是 。
下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
(1)用电子式表示H的形成过程____________________;
(2)写出E溶液与过量I溶液反应的离子方程式______________________________。
(3)实验室还可用C的浓溶液与F制备气体C,反应理由是__________________________________________________。
(4)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A化学式为__________。
试题篮
()