短周期元素A、B、C、D、E的原子序数依次增大,A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)C、D、E的简单离子半径由小到大的顺序 (用离子符号表示)。
(2)工业上常用A和B的单质合成一种常见气体,该气体的电子式 。检验该气体的常用方法是 。
(3)D2C2与H2O反应的化学方程式是 ,D2C2与CuSO4溶液反应的现象是 。(4)A、B、C三种元素可组成一种常见离子化合物,其水溶液呈酸性,该溶液中离子浓度由大到小的顺序是 。
(5)电动汽车的某种燃料电池,通常用NaOH作电解质,用E单质、石墨作电极,在石墨电极一侧通入空气,该电池的负极反应: 。
(19分) A + B → X + Y + H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是 ;
②当A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:__________________________________________。
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)_____________________________________________________________。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为______,检查其中刺激性气体产物X的方法是____________________。
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为_____________。
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X是 mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 。
(5)若A、B、X、Y均为化合物。X为极易溶于水的气体,则盐A是_______盐,X极易溶于水的原因是:________________________________________________。
已知有以下物质相互转化:
(1)A转化为B及气体这步反应中应加入的试剂是(填化学式) ;
(2)写出B的化学式 ,F的化学式 ;
(3)写出由G转变成H的化学方程式 ;
(4)写出检验I溶液中阳离子的离子方程式 ;
向I溶液中加入A的有关离子反应方程式是 。
(14分)黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m 1 g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:
4FeS2+11O2 2Fe2O3+8SO2 4FeS+7O2
2Fe2O3+8SO2 4FeS+7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:
(1)鼓入空气的作用是__________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是_______________(用化学方程式表示)。
H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为__________(列出表达式即可)。
【实验二】:测定铁元素的含量
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_______。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 消耗KMnO4溶液体积/mL |
25.00 |
25.03 |
20.00 |
24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =___________。
(14分)A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
(1)D的离子结构示意图为_____________。
(2)B、C、D形成的简单离子半径由大到小的顺序: > > (写离子符号)
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到60 mL 10.0 mol/L乙的浓溶液中,充分反应,共收集到4.48L(标准状况)气体,则该气体的成分是_________,反应中电子转移数为____________。若使上述中反应后剩余的铜片继续溶解,可向其中加入稀硫酸,写出反应的离子方程式: 。
(4)将两份足量的B单质分别加入到等体积等浓度的硫酸和NaOH溶液中,充分反应生成气体的体积比为__________,若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为_____________________________________。
(14分)掌握物质之间的转化,是学习元素化合物知识的基础。
(1)中学常见的某有色物质,全部由短周期元素组成,能与水发生氧化还原反应,但反应中水既不作氧化剂也不作还原剂。试写出符合条件的两种不同种类的物质(写化学式)_________________、________________。
(2)中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去)。若C、D均为气体,且都能使澄清石灰水变浑浊。
某探究性学习小组利用下图中所列装置实验,
证明上述反应中有C、D生成。则b瓶溶液的作用是_____________,装置d中所盛溶液是______。
(3)在一定条件下,RO3nˉ和Iˉ发生反应,离子方程式为: RO3nˉ+6Iˉ+6H+==Rˉ+3I2+3H2O , RO3n-中R元素的化合价为 ,R元素的原子最外层电子有 个。
(4)已知M2On2ˉ可与R2ˉ作用,R2ˉ被氧化为R的单质,M2On2ˉ的还原产物中,M为+3价,又知c(M2On2ˉ)=0.3mol/L的溶液100mL可与c(R2ˉ)=0.6mol/L的溶液150mL恰好完全反应,则n值为
下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。请按要求填空:

(1)写出B的电子式:____________________。
(2)反应⑤的现象是_____________________________________________。
(3)反应①的化学反应方程式是______________________________________,
在实验室引发反应④的操作是____________________________________。
(4)反应⑥的离子方程式是_________________________________________。
(1)现有下列四种物质:①AlCl3 ②NH3 ③NaHCO3 ④SiO2。
为石英主要成分的是 (填序号,下同),能进行喷泉实验,极易溶于水的气体是 ,向其溶液中,逐滴加入氢氧化钠溶液,先产生白色沉淀,后沉淀溶解的是 ,俗称为“小苏打”的是 。
(2)483克Na2SO4·10H2O所含的Na+的物质的量是 ,SO42-的物质的量是 。
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题:
(1)D的化学式为 。
(2)写出实验室制Y的化学方程式 。
(3)反应③的离子方程式为 。
(4)写出反应①的化学方程式 。
(5)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(6)常温下0.1 mol·L-1的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1 mol·L-1
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1 mol·L-1的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH为9
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
图G52
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的2个用途:__________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:__________________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:__________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:____________________。D的化学式是______。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:_______________________________。
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空:
(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_________。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:_______________________________________________________。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。
(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式_________________________________________。
(3)反应②的离子方程式_______________________________________________。
(4)F→G的化学方程式___________________________________________。
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如下图所示(部分产物已略去)

(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为____________。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则①C的化学式为________________。
②反应B+A→C的离子方程式为____________________________。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)
①若图b符合事实,则D为________(填化学式),此时图b中 ________7(填“﹥”“﹤”“=”)。若图c符合事实,则其pH变化的原因是_____________(用离子方程式表示)。
________7(填“﹥”“﹤”“=”)。若图c符合事实,则其pH变化的原因是_____________(用离子方程式表示)。
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出1molA和D反应生成C的反应热为ΔH=________________。
如图是广州亚运会开幕式“红棉花开迎宾来”焰火盛宴的一个场景,
请回答下列问题:
(1)焰火利用了部分金属的元素特征的 反应,该反应属于 (填“物理”或“化学”)变化。
(2)现在有一种火焰的引发是当浓H2SO4滴下去跟氯酸钾起作用时,便生成了奇臭的二氧化氯气体,且发现只有氯元素的化合价发生变化。请写出该反应的方程式 。
(3)如图所示的五元环代表A、B、C、D、E五种化合物,
圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
①D的化学式是_________.
②A、B、E中均含有的一种元素名称为______________。
③B的电子式是______________。
④C与纯碱反应的化学方程式为 。
如图所示的框图中,A~I都是由短周期元素组成的常见物质。其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料。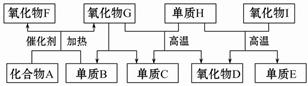
(1)化合物A的化学式是_______________________。
(2)组成单质E的元素在元素周期表中的位置是____________________________;
H+I反应的化学方程式为______________________________________。
(3)标准状况下,将2.24 L氧化物F和1.68 L单质B同时通入1 L氧化物G中(反应前后溶液体积的变化忽略不计),所得溶液的pH=___________。此时再向溶液中通入2.24 L化合物A,完全反应后所得溶液的pH<7,用离子方程式表示其原因:____________________________________。
(4)单质B和单质C在一定条件下可组成原电池(用KOH溶液作电解质),则该原电池负极的电极反应式为________________________________________________。
试题篮
()