X、Y、Z、Q、W、R六种短周期元素原子序数依次增大,化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13,工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成。请回答以下问题:
(1)Q的原子结构示意图为 。
(2)Y元素的单质能发生如图所示的转化,则Y元素为 (用元素符号表示)。在甲溶液中通入足量YZ2气体,所得溶液呈碱性,原因是 (用离子方程式和必要的文字说明)。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为:
②Q、W两种元素金属性的强弱为Q W(填“>”、“<”);
下列表述中证明这一事实的是 。
a.Q的单质的熔点比W单质低
b.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
c.W的原子序数大
(6分) A、B、C等八种物质有如下框图所示转化关系。已知,A是由地壳中含量最多的金属元素形成的单质,C、D、E是常见的由短周期元素形成的气体单质,气体F与气体G相遇产生大量的白烟,H是厨房中必备一种调味盐(部分反应物和生成物及溶剂水已略去)。
请回答下列问题:
(1)B的化学式为_______________。
(2)F的电子式为_______________。
(3)写出反应①的离子方程式: 。
(4)写出反应②的化学方程式: 。
如图I是广州亚运会开幕式“红棉花开迎宾来”焰火盛宴的一个场景,请回答下列问题:
(1)焰火利用了部分金属的元素特征的( )反应。
(2)现在有一种火焰的引发是当浓H2SO4滴下去跟氯酸钾起作用时,便生成了其臭的二氧化氯气体,且发现只有氯元素的化合价发生变化,请写出该反应的方程式 。
(3)如图2所示的五元环代表A,B,C,D,E五种物质,圆圈交叉部分指两种化合物含有一种相同元素,五种物质有五种短周期元素组成,每种化合物仅含两种元素,A是沼气的主要成分,B,E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液时医疗上广泛使用的消毒剂,E的分子结构模型为 C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数比为3:2.根据上信息回答下列问题:
C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数比为3:2.根据上信息回答下列问题:
①D的化学式是 ;
②B的电子式是 ;
③C与纯碱反应的化学方程式为 。
已知物质A、B、C、D、E是由短周期元素构成的单质或化合物,它们可发生如图所示的转化关系:
(1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式_____________。将气体D作为燃料电池的燃料源可以制成D—空气燃料电池系统,总反应式为:D+O2 A+H2O(未配平),写出此碱性燃料电池的负极反应式:________________。
A+H2O(未配平),写出此碱性燃料电池的负极反应式:________________。
(2)若条件①为加热,E是一种两性氢氧化物,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则C为____________(写化学式)。
(3)若条件①为常温,B和D为同种无色气体,常温下E的浓溶液可以使Fe钝化,写出少量Fe粉与E的稀溶液反应的离子方程式:_________________________________。
已知常温下1molC与H2O反应生成气体D和E溶液放出46kJ热量,写出C与水反应生成D和E的热化学方程式:________________________。
有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。一种由废催化剂制取PdCl2的工艺流程如下:
(1)“焙烧1”通入空气的目的是 。
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式 。
(3)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室中检测溶液pH的简单方法是 。
(4)写出“焙烧2”发生反应的化学方程式: 。
(5)Pd中加入王水的反应可以表示为:Pd+HCl+HNO3 → A+B↑+H2O(未配平)。其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%。则A的化学式为: 。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是: 。
不采用铜跟浓硫酸反应来制取硫酸铜的原因是 。
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
(4)将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为 。
甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物。
(1)若工业上用该反应制粗硅,写出该反应的化学方程式: 。
(2)若该反应可用于焊接铁轨,且丙为红棕色固体,则该反应的化学方程式为: 。
(3)若丁为具有磁性的黑色晶体,写出该反应的化学方程式: 。
(4)若甲为黄绿色气体,且该反应用来检验工业上甲是否泄漏,写出该反应的化学方程式: 。若该反应用于实验室甲气体的检验则离子方程式为: 。
(9分) 在下列物质转化中,已知A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系:
说明:当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。(已知H2CO3、H2S、H2SO3、H2SiO3皆为二元弱酸)
请回答下列问题:
(1)A是 ,Y是 ,Z是 (填化学式,下同)。
(2)当X是强酸时,E是 ,写出B生成C的化学方程式: _____ 。
(3)当X是强碱时,E是 ,写出D生成E的离子方程式: _____。
已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系。
(1)若A为金属铝,B为氧化铁,该反应的一种用途是 。
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,该反应的化学反应方程式为 。
(3)若A是淡黄色粉末,常用作供氧剂,C为强碱,则该反应的化学反应方程式为 。
(4)若A、B、D都是有机化合物,其中A、B是家庭厨房
中常见调味品的主要成分,且A的相对分子质量比B大14。
①反应的化学反应方程式为 。
②某种以B为反应物的新型电池如图所示,该电池的负极的电极反应式为 。
现有下列4种物质:① NH3、② SO2、③ NaHCO3、④ Ca(ClO)2。其中,受热分解产生CO2的是 (填序号,下同);遇氯化氢产生白烟的是 ;能使湿润的蓝色石蕊试纸变红的是 ;可由氯气与冷的消石灰反应制得的是 。
(8分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。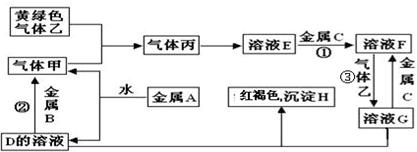
(1)写出下列物质的化学式:F中的溶质 _________; 丙____________。
反应③的离子方程式
H受热分解后的固体产物与金属B高温下的化学方程式:_______________________
A与水反应的离子方程式
(8分)分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物质 |
需加入的试剂 |
有关离子方程式 |
| FeSO4 (Fe2(SO4) 3) |
|
|
| Mg(Al) |
|
|
| CO2 (HCl) |
|
|
| SiO2(CaCO3) |
|
|
(7分)A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去)填写下列空白:
(1)若A为金属铝,B为氧化铁,写出反应A+B→C+D的一种用途
(2)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式 。
(3)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于刻制印刷电路板,该反应的离子方程式 。
(4)若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是
已知A为一种盐,隔绝空气加热的条件下发生下述变化,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为常见的单质,I为常见的无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
(1)写出G的电子式____________________,M的化学式_________________。
(2)写出反应②的离子反应方程式_________________________________。
(3)写出反应③的化学反应方程式_______________________,反应①—④中属于非氧化还原反应的是_______________。
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极:___________________________
阳极:__________________________________
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为
B:C:D:E:F=1:2:2:1:2,写出A分解的化学反应方程式____________________________。
U、W、X、Y、Z都是短周期元素,且原子序数依次增大。其中U与W可形成三角锥形分子A,U与X可形成常温下呈液态的分子B,A、B均为10电子分子;Y元素原子的K层电子数与M层电子数相同;Z元素的单质、氧化物均为原子晶体。请回答下列问题:
(1)Z元素在周期表中的位置______________ 。W、X、Y、Z四种元素的原子半径由小到大的顺序是______________ (用元素符号表示)。
(2)用电子式表示U与X形成的18电子化合物的形成过程________ 。
(3)ZX2与NaOH溶液反应的离子方程式 。
(4)一定量的Y单质在足量二氧化碳中充分燃烧的化学方程式是______________,将生成的全部固体与足量的热浓硝酸混合,充分反应后,产物中二氧化碳和二氧化氮共aL(标准状况),则 Y 单质的质量是______________ g(用含a的代数式表示)。
试题篮
()