20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。在反应体系中加入催化剂,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”),对反应热是否有影响?_______________,原因是_________ 。
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
① P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式 。
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2______△H1(填“大于”、“小于”或“等于”),原因是 。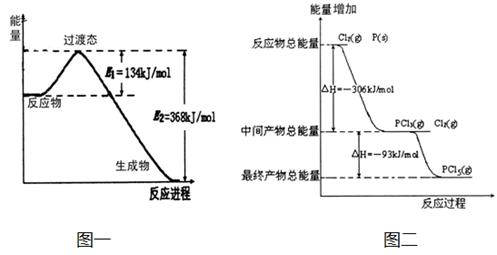
(1)在25℃、101kPa下,1g CH4(g)完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
(2)Zn(s) + O2(g) = 2ZnO(s) ΔH1= ?702 kJ/mol
2Hg(l) + O2(g) = 2HgO(s) ΔH2= ?182 kJ/mol
由此可知ZnO(s) + Hg(l) = Zn(s) + HgO(s) △H3= 。
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。右图是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
下表为部分短周期元素化合价及相应氢化物沸点的数据:
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 原子半径 |
0.102 |
0.075 |
0.117 |
0.074 |
0.110 |
0.071 |
0.099 |
0.077 |
| 最高化合价 |
+6 |
+5 |
+4 |
|
+5 |
|
+7 |
+4 |
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:①A与D可形成化合物AD2、AD3,②B与D可形成多种化合物,其中BD、BD2是常见的化合物,C可用于制光电池。请回答:
(1)E在周期表中位置是 :
(2)C和H的气态氢化物的稳定性强弱关系为: (用分子式表示)
(3)32g AD2气体和D2气体恰好完全反应生成AD3气体,放出49.15kJ的热量,则其反应热化学方程式为:
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是: 。
(5)工业上可用纯碱溶液处理BD和BD2,该反应如下:
BD+BD2+Na2CO3=2 +CO2横线上某盐的化学式应为
指出下列反应属于吸热反应还是放热反应。
①燃烧木炭取暖 ; ②煅烧石灰石制生石灰 ;
③Ba(OH)2·8H2O晶体与氯化铵晶体反应 ; ④铝与稀盐酸反应 ;
⑤食物因氧化而腐败 ; ⑥生石灰与水作用制熟石灰 ;
⑦灼热的炭与二氧化碳反应 ; ⑧酸碱中和反应 。
(16分)能源危机是当前全球问题,开源节流是应对能源危机的重要举措。
⑴下列做法有助于能源“开源节流”的是 ▲ (填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如右图所示。 
(a)在通常状况下,金刚石和石墨中____▲___(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为____▲___ kJ·mol-1。
(b)12 g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量 ▲ kJ。
(3)已知:N2(g)+O2(g)=2NO(g);ΔH=+180.0 kJ·mol-1。
综合上述有关信息,请写出CO除NO的热化学方程式 ▲ 。
美国斯坦福大学研究人员最近发明一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电。
(4)研究表明,电池的正极用二氧化锰纳米棒为材料可提高发电效率,这是利用纳米材料具有
▲ 特性,能与钠离子充分接触。
(5)海水中的“水”电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,该电池负极反应式为 ▲ ;当生成1 mol Na2Mn5O10转移 ▲ mol电子。
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)===CO(g)+3H2(g);ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g);ΔH=247.4 kJ·mol-1
2H2S(g)===2H2(g)+S2(g);ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为____________________________。
(2) H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是________________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:________________________。
(3) H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A.B表示的物质依次是________。
图1

图2
(4)电解尿素[CO(NH2)2 ]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴.阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(5) Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________________________。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。
根据上述数据可计算:N-H键的键能是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
(6分)按要求回答下列问题:
(1)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
(2)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应生成正盐时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式
_____________ 。
(3)已知下列反应的焓变:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) △H2=-393.5kJ/mol
③2 H2(g)+O2(g) =2H2O(l) △H3=-285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=
已知下列热化学方程式:
①H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,
回答下列问题:
(1)上述反应中属于放热反应的是____________。
(2)H2的燃烧热为____________;C的燃烧热为____________。
(3)燃烧10 g H2生成液态水,放出的热量为____________。
(4)写出CO燃烧的热化学方程式__________________________________。
(5分)能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1))氢气在燃烧时,放出大量热量,说明该反应是 热反应,这是由于反应物的总能量 生成物的总能量(填“大于”、“小于”或“等于”,下同);从化学反应的本质角度来看,由于断裂反应物中的化学键吸收的总能量 形成产物的化学键放出的总能量
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2g氢气燃烧时放出286kJ热量,而每千克汽油燃烧时放出的热量为46000kJ。试据此分析氢气作为能源代替汽油的优势
。
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示
意图,请写出NO2和CO反应的热化学方程式__________________________________
在反应体系中加入催化剂,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”),对反应热是否有影响?_______________,
原因是_
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
① PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)
的△H2关系是:△H2______ △H1(填“大于”、“小于”或“等于”),原因是


“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)  1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
_______________________________________________________________________。
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:___________________________________。
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为______________mol。
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH——4e— = O2↑+2H2O,则阴极反应为:____________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?_______,理由是:___________________________________。
常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol (理想)气体分子化学键所放出的能量称为键能。下表是一些键能数据(单位为KJ·mol-1)
| 化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
| C-F |
427 |
C-Cl |
330 |
C-I |
218 |
| H-H |
436 |
S=S |
255 |
H-S |
339 |
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:
_________ <C-Br键能<__________
(2)热化学方程式2H2(g)+S2(g) =2H2S(g);△H= QKJ·mol-1;则Q=
(3)
 已知下列热化学方程式:
已知下列热化学方程式:
O2 (g) = O+2(g) + e— △H1=" +1175.7" kJ·mol-1 PtF6(g) + e—= PtF6—(g) △H2="-771.1" kJ·mol-1
PtF6(g) + e—= PtF6—(g) △H2="-771.1" kJ·mol-1 O2+PtF6—(s) = O2+(g) + PtF6—(g) △H3=" +482.2" kJ·mol-1
O2+PtF6—(s) = O2+(g) + PtF6—(g) △H3=" +482.2" kJ·mol-1 则反应O2(g) + (g) = O2+PtF6— (s)的△H="___________________" kJ·mol-1。
则反应O2(g) + (g) = O2+PtF6— (s)的△H="___________________" kJ·mol-1。
(4)已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:
C(金刚石,s)+O2(g) =CO2(g) △H=-395.4 kJ?mol-1
C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ?mol-1
则石墨转化为金刚石时的热化学方程式为
由此看来碳的这两种同素异形体中更稳定的为 。
家用液化气中的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧反应的热化学方程式:________________________。已知1 mol 液态水汽化时需要吸收44 kJ的热量,则1 mol 丁烷完全燃烧并生成气态水时放出的热量为______kJ。
试题篮
()