(每空2分,共6分)热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
(1)如下图Ⅰ所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________________________。
(2)图Ⅱ表示氧族元素中的氧、硫、硒、碲在生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准态下,发生分解反应的热化学方程式:_________________________________________________。
(3)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);
ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);
ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);
ΔH=19 kJ·mol-1
请写出CO还原FeO的热化学方程式:
________________________________________________________________________。
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 |
起始时各物质物质的量/mol |
达到平衡的时间/min |
达平衡时体系能量的变化/kJ |
||||
| CO |
H2O |
CO2 |
H2 |
||||
| ① |
1 |
4 |
0 |
0 |
t1 |
放出热量:32.8 kJ |
|
| ② |
2 |
8 |
0 |
0 |
t2 |
放出热量:Q |
|
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量 (填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)下列叙述正确的是 (填字母序号)。
A、平衡时,两容器中H2的体积分数相等
B、容器②中反应达平衡状态时,Q > 65.6 kJ
C、反应开始时,两容器中反应的化学反应速率相等
D、容器①中,化学反应速率为:
(4)已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式: 。
(5)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 ml 、5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
甲 + 乙 丙 + 丁 + 水。
丙 + 丁 + 水。
(1)若丙为NO2。
①甲与乙反应的化学方程式为 。
②火箭常用NO2的二聚体N2O4作氧化剂,肼(N2H4)作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H =-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-534.0kJ·mol-1
2NO2(g) N2O4(g) △H =-52.7kJ·mol-1
N2O4(g) △H =-52.7kJ·mol-1
试写出气态肼(N2H4)在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
___________________________________________________。
③肼又称联氨,广泛用于火箭推进剂、有机合成及燃料电池。肼燃料电池原理如右图所示,右边电极为 (填“正极”、“负极”),左边电极上发生的电极反应式为 。
(2)若丙为SO2。
①把乙滴入硫酸铜晶体中,观察到的现象是 。
②SO2气体有毒,多余的SO2气体常用足量的NaOH溶液吸收,写出吸收液中离子浓度由大到小的顺序: 。
③在氧化还原反应的过程中,氧化反应和还原反应同时发生,有关反应:
SO2-2e-+2H2O = SO42-+4H+反应的说法错误的是 。
| A.该反应为氧化反应 |
| B.上述反应中若转移电子物质的量为0.05mol,则生成溶液的PH值为1 |
| C.Fe2(SO4)3、品红两种溶液都能使上述反应进行 |
| D.通入Cl2会降低SO2的漂白作用 |
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol的ΔH=—99kJ·mol—1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol的ΔH=—99kJ·mol—1.请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol—1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率υ(SO2)为0.05 mol·L—1·min—1,则υ(O2)= mol·L—1·min—1、
υ(SO3)= mol·L—1·min—1;
(5)已知单质硫的燃烧热为296 KJ·mol—1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(6)甲烷燃料电池(KOH作电解质溶液)
负极反应方程式是:
正极反应方程式是:
总反应方程式是:
(7)常温下,设pH 均为5的H2SO4和A12(SO4)3溶液中由水电离出的c(H+)分别为c1、c2,则c1:c2= 。
(8)浓度为0.5 mol/L的盐酸与等浓度的氨水溶液反应,使溶液呈中性,则混合前体积V酸________V碱(填“大于”、“小于”或“等于”)
(9)取10 mL溶液0.5 mol/L的盐酸,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
(12分)甲醇作为新型汽车动力燃料,工业上可由CO和H2合成。该反应的热化学方程式:
该反应的原料CO和H2本身可作为燃料,它们的热化学方程式为:

某些化学键的键能数据如下表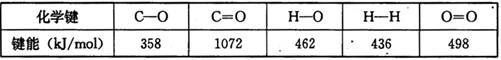
请回答下列问题:
(1)反应③中的ΔH3=________kJ/mol
(2) CH3OH燃烧生成CO2(g)和H2O(g)的热化学方程式为 ,该反应的焓变
,该反应的焓变 =________kJ/mol (用含a、b的式子表示);
=________kJ/mol (用含a、b的式子表示);
(3) 若降低温度,反应①的化学平衡常数K值将________ (填“增大”、“减小”或“不变”);
(4) 甲醇一空气电池是一种髙效、低污染质子交换腆燃料电池,电池总反应为 。甲醉在催化剂作用下提供质子和电子。右图为该电池的示意图,则电极d上发生的电极反应式为________________。
。甲醉在催化剂作用下提供质子和电子。右图为该电池的示意图,则电极d上发生的电极反应式为________________。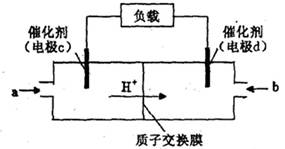
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计 成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
(1)工业上一般采用下列两种反应合成甲醇
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
上述反应符合“原子经济”原则的是: (填“I”或“Ⅱ”)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O (g) ΔH =-1275.6 kJ·mol-1
(g) ΔH =-1275.6 kJ·mol-1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ·mol-1
③ H2O(g) = H2O(l) ΔH =-44.0 kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
__________________________________________________
(3)甲醇—空气燃料电池,电解质溶液是:20%~30%的KOH溶液。请写出甲醇—空气燃料电池放电时正极的电极反应式。
。
(4)下图是一个电化学过程示意图。
①锌片上发生的电极反应式为 。
②假设使用甲醇—空气燃料电池作为本过程中的电源,铜片的质量变化96g,则燃料电池理论上需要  mol甲醇。
mol甲醇。
CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,随后,他向烧杯中加入了一定量的 溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
①图一是根据反应Zn + CuSO4== Cu + ZnSO4设计成的锌铜原电池。Cu极的电极反应式是 ,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向 移动(填“甲”或“乙”)。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 ;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为 L。
(3)反应一段时间后,燃料电池的电解质溶液完全转化为K2CO3溶液,以下关系正确的是 。
| A.c(K+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.c(K+)>c(CO32-)>c(H+)>c(OH-) |
| D.c(K+)>c(CO32-)>c(OH-)>c(HCO3-) |
E.c(K+)= 2c(CO32-)+ c(HCO3-)+c(H2CO3)
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO (g) + 2H2(g)  CH3OH (g) △H 1 (反应1)
CH3OH (g) △H 1 (反应1)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为: △H2=-283 kJ·mol-1 (反应2)
△H2=-283 kJ·mol-1 (反应2) △H3=-242 kJ·mol-1 (反应3)
△H3=-242 kJ·mol-1 (反应3)
某些化学键的键能数据如下表:
| 化学键 |
C-C |
C-H |
H-H |
C-O |
C O O |
H-O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)反应1的焓变△H1= 。
(2)CH3OH (g)燃烧生成CO2( g)和H2O(g)的热化学方程式为:
g)和H2O(g)的热化学方程式为:
CH3OH(g)+ O2(g) ="=" CO2(g)+2H2O(g) △H4 该反应的焓变△H4= 。
O2(g) ="=" CO2(g)+2H2O(g) △H4 该反应的焓变△H4= 。
(3)反应1的平衡常数表达式为 。
为提高甲醇的产率,可以采取的措施有 (写出2点)。既能提高产率,又能提高反应速率的措施是 。
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+ O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下:
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为 。
(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1=" —285.8" kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=" —889.6" kJ/mol
H2O(l)=H2O(g) △H3=" +44.0" kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C 4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4 mol A和2 mol B,发生如下反应:
2A(g) + B(g)  C(g) + D(g) △H =" Q" kJ·mol-1
C(g) + D(g) △H =" Q" kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 mol B B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 mol D D.2 molA、1mol B、1 mol C、1 mol D
(15分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。
(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molCO 、2molH2 |
1mol CH3OH |
2molCO、4molH2 |
| CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
| 平衡常数 |
K1 |
K2 |
K3 |
| 反应物转化率 |
α1 |
α 2 |
α3 |
下列说法正确的是 。
a. c1=c2 b. 2Q1=Q3 c. K1=K3 d. α2+ α3< 100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)= mol。
②下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。
b电极是 极;a电极的反应式为 。
已知热化学方程式H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ/mol,
(1)实验室用0.25 L 0.10mol/L的一元强酸和强碱中和,若中和后溶液体积为0.5 L,中和后的溶液的比热容为4.2×10-3kJ/(g·℃),且密度为1.0g/mL,则溶液温度升高____________℃。
(2)将V1mL 1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
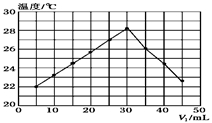
A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.0mol/L
D.该实验表明有水生成的反应都是放热反应
(3)关于用水制取二级能源氢气,以下研究方向不正确的是( )
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在不分解的情况下,使氢气成为二级能源
B.设法将太阳能聚焦产生高温,使水分解产生氢气
C.寻找催化剂使水分解,同时释放能量
D.寻找特殊化学物质用于开发廉价能源,以分解水取得能源
(4)在高温下一氧化碳可将二氧化硫还原为单质硫。
①C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g)ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g)ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式: 。
试题篮
()