某实验活动小组在实验室进行中和 反应反应热的测定。请回答下列问题:
反应反应热的测定。请回答下列问题:
(1)测定中和反应反应热的实验装置如图所示。在两个烧杯之间填弃碎泡沫塑料的目的是 。
(2)在进行中和反应反应热的测定中,量取50 mL 0.50mol/L的盐酸,倒入小烧杯中,测量盐酸的温度,然后需加入下列 试剂(填序号)
①50mL 0.50mol/L NaOH溶液
②50mL 0.55mol/L NaOH溶液
③1.0g NaOH固体
(3)下述情况会使中和反应反应热的测定结果偏小的是(填序号)
a.用量筒量取50mL 0.50mol/L的盐酸时仰视读数
b.分多次把(2)中所选试剂倒入盛有盐酸的小烧杯中
c.用醋酸代替盐酸
在密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇: CO的转化率与温度、压强的关系如图所示。
CO的转化率与温度、压强的关系如图所示。

(1)若A、B两点表示在某时刻达到的平衡状态。将混合气体加热至200℃,自反应开始达到平衡状态A点所需要的时间为a min,容器体积为b L。反应达A点时此过程的反应速率为v(CO)= mol/(L·min),则该温度下的平衡常数KA= 。B点时容器的体积VB= b L (填“>”、“<”或“=”)。此反应的反应热
△H= 0(填“>” 或“<”)
或“<”)
(2)若A、C两点分别表示某温度、压强下达到的平衡状态。则自反应开始达到平衡状态所需要的时间tA tC(填“>”、“<”或“=”)
(3)在不改变反应物用量情况下,为提高CO转化率可采取的措施是 (写出一种方法即可)
现有下列物质:
①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡
⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的电解质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(4)在水溶液中,不能完全电离的是 ;
(1)实验室在配制氯化铁溶液时,常出现少许浑浊,原因离子方程式表示为 。为防止出现这样的现象,在配制时常加入
(2)根据下列2个热化学反应方程式:
FeO(s)+CO(g)=" Fe(s)+" CO2(g) △H= ―218kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:
______________
(4)常温下,等物质的量的浓度的①氨水 ②NH4HSO4 ③NH4Cl ④(NH4)2CO3
⑤(NH4)2SO4溶液中,c(NH4+)由大到小的顺序为_____________________________(填序号)
化学反应中既有物质变化,又有能量变化,释放或吸收热量是化学反应中能量变化的主要形式之一。已知C(石墨)、H2(g)燃烧的热化学方程式分别为:
① C(石墨)+ O2(g)=CO(g)
O2(g)=CO(g)  ="-111.0" KJ·mol-1
="-111.0" KJ·mol-1
② H2(g)+  O2(g) =H20(g)
O2(g) =H20(g)  ="-242.0" kJ·mol-1
="-242.0" kJ·mol-1
③ C(石墨)+O2(g)=CO2(g)  ="-394.0" kJ·mol-1
="-394.0" kJ·mol-1
请解答下列问题:
(1)化学反应中有能量变化的本质原因是反应过程中有 的断裂和形成。上述三个反应都是 (填“吸热”或“放热”)反应。
(2)在热化学方程式中,需要标明反应物及生成物的状态的原因是 ;在①中,02的化学计量数“1/2”是表示 (填字母)。
a.分子个数 b.物质的量 c.气体的体积
(3)反应2H20(g)=2H2(g)+02(g)的 = KJ·mol-1。
= KJ·mol-1。
(4)若C(金刚石)+02(g)=C02(g)的 ="-395.0" kJ·mol-1,则稳定性:金刚石 (填“>”、“<”或“=”)石墨。
="-395.0" kJ·mol-1,则稳定性:金刚石 (填“>”、“<”或“=”)石墨。
(5)已知形成H20(g)中的2 mol H-O键能放出926.0 kJ的能量,形成1 mol 02(g)中的共价键能放出498.0 kJ的能量,则断裂1 mol H2(g)中的H-H键需要的能量 KJ。
(6)工业制氢气的一个重要途径是用CO(g)与H2O(g)反应生成C02(g)和H2(g),则该反应的热化学方程式是 。
已知:H+(aq)+OH-(aq)= H2O(l) ΔH="-57.3" kJ/ mol,计算下列中和反应中放出的热量:
(1)用20 g NaOH配成的稀溶液跟足量的稀盐酸反应,能放出 kJ的热量。
(2)用0.1 mol Ba(OH)2配成的稀溶液跟足量的稀硝酸反应,能放出 kJ的热量。
(3)用1 mol醋酸稀溶液和足量NaOH稀溶液反应,放出的热量 (填“大于”、“小于”或“等于”)57.3 kJ,理由是 。
(4)1 L 0.1 mol/L NaOH溶液分别与①醋酸溶液、②浓硫酸、③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位:kJ)。则它们由大至小的顺序为 。
2008年北京奥运会所用火炬燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷(C3H8),已知常温下1mol丙烷燃烧放出2220kJ热量,1mol正丁烷燃烧放出2878kJ热量,1mol异丁烷燃烧放出2869.6kJ热量。试回答下列问题:
(1)表示正丁烷燃烧的热化学反应方程式 ;
(2)下列有关说法正确的是 ;
| A.奥运火炬燃烧时的能量转化主要是由化学能转变为热能 |
| B.相同条件下相同质量的正丁烷和丙烷充分燃烧,放出的热量正丁烷的比较多 |
| C.正丁烷比异丁烷不稳定 |
| D.异丁烷分子中的碳氢键比正丁烷的多 |
(3)已知1mol H2燃烧生成液态水放出热量是285.8 kJ,现有5mol 氢气和丙烷的混合气体,完全燃烧时放热3847kJ,则氢气和丙烷的体积比为 。
(6分)(1)氨气催化氧化生产硝酸,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)= 2H2O(g) ΔH="-483.6" kJ·mol-1
N2(g)+2O2(g)= 2NO2(g) ΔH="+67.7" kJ·mol-1
则H2还原NO2生成水蒸气反应的热化学方程式是 。
(2)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g) 2NH3(g) ΔH="-92" kJ·mol-1。请回答下列问题:
2NH3(g) ΔH="-92" kJ·mol-1。请回答下列问题:
①取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92 kJ(填“大于”“等于”或“小于”),原因是 ;
将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_______________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点___________________________________________________。
2SO2(g)+O2 (g)= 2SO3 (g),反应过程的能量变化如图所示。已知:1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ/mol。
请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中ΔH= kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)= mol/(L·min);
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程)。
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H < 0 ,其平衡常数K与温度T的关系如下表:
2NH3(g) △H < 0 ,其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K=
②试判断K1 K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)= ,以NH3表示该过程的反应速率v(NH3)= 。
(5) 实验室制取氨气的化学反应方程式 .
(18分)钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
⑴电解食盐水时,总反应的离子方程式_____________________________________。
⑵写出钛铁矿经氯化法得到四氯化钛的化学方程式:___________________。
⑶已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH____________________
反应 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。
⑷在上述产业链中,合成192 t甲醇理论上需额外补充H2__________t(不考虑生产过程中物质的任何损失)。
⑸以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________________________________。
(6)已知2A2(g)+B2(g)  2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
①比较a____________b(填>、=、<)
②此反应的平衡常数表达式为________________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)
③能说明该反应已经达到平衡状态的是______。
| A.v(C3)=2v(B2) | B.容器内压强保持不变 |
| C.v逆(A2)=2v正(B2) | D.容器内的密度保持不变 |
(1)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为
________________________________________________。
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为 ;
又知H2O(l) H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ。
H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ。
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H =
在量热计中(如图)将100 mL 0.50 mol/L的CH3COOH溶液与100 mL 0.55 mol/L NaOH溶液混合,温度从298.0 K升高到300.7 K.已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J/K,溶液密度均为1 g/mL,生成溶液的比热容c=4.184 J/(g·K).
(2) CH3COOH的中和热ΔH=_______________________________.
(3)CH3COOH的中和热的文献值为-56.1 kJ/mol,你认为(1)中测得的实验值偏差可能的原因是(填二点)____________________________________________
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题: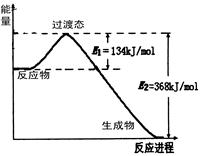
右图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
试题篮
()