保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:
过程Ⅰ可用如下反应表示:
①2CO2 2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O
2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O 4NH3+3O2 ④2CO2+4H2O
4NH3+3O2 ④2CO2+4H2O 2CH3OH+3O2 ⑤2CO+4H2O
2CH3OH+3O2 ⑤2CO+4H2O ________+3O2
________+3O2
请回答下列问题:
(1)过程Ⅰ的能量转化形式为________能转化为________能。
(2)请完成第⑤个反应的化学方程式:____________________。
(3)上述转化过程中,ΔH1和ΔH2的关系是________。
(4)断裂1 mol化学键所需的能量见下表:
| 共价键 |
H—N |
H—O |
N≡N |
O===O |
| 断裂1 mol化学键所需能量/(kJ·mol-1) |
393 |
460 |
941 |
499 |
常温下,N2与H2O反应生成NH3的热化学方程式为_________。
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。
(l)图中所示反应是______(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H=_______(用含 、
、 的代数式表示)。
的代数式表示)。
(2)已知热化学方程式:H2(g) + O2(g)═H2O(g);△H=-241.5kJ/mol,该反应的活化能为167. 4kJ/mol,则其逆反应的活化能为________________。
O2(g)═H2O(g);△H=-241.5kJ/mol,该反应的活化能为167. 4kJ/mol,则其逆反应的活化能为________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_____________。
(6分)通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能. 已知部分化学键的键能如下:
| 化学键 |
N—H |
N—N |
O==O |
N≡N |
O—H |
| 键能(kJ/mol) |
386 |
167 |
498 |
946 |
460 |
(1)发射神舟飞船的长征火箭用了肼(N2H4,气态)为燃料,若它在氧气(气态)中燃烧,生成N2(气态)和H2O(液态).1 mol肼完全燃烧时放出的热量为________ .
(2)为了提高肼(N2H4)燃烧过程中释放的能量,常用二氧化氮作氧化剂代替氧气,这两者反应生成氮气和水蒸气.且:
①N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol
②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol
试写出肼和NO2完全反应的热化学方程式:____________________________________
(3)随着中国空间技术的发展,中俄于2009年携手探火星工程,寻找更高效的火箭推进剂也被提到了议事日程.在实验室我国科研人员应用电子计算机模拟出具有高能量的物质N60,它的结构与C60十分相似.已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构.试推测1个N60的结构含有________个N—N键.
2SO2(g)+ O2(g) 2SO3(g) △H =- a kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g) △H =- a kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
⑴图中A点表示__________________,a=__________。
⑵Ea的大小对该反应的△H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_________(填“升高”、“降低”或“不变”)。
⑶已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:_____________________,常温常压下,由单质硫和氧气经两步反应,生成3 mol SO3(g),放出的总热量为___ _。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v(CO2)表示的反应速率为 (保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 (填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:
。
⑷某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池负极的电极反应为: 。
②该电池工作时,溶液中的OH-向______极移动。
(1)已知拆开1molH-H键,lmolN-H键,1mol 键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。已知:
则白磷的稳定性比红磷_____________(填“高”或“低”),理由是________________
__________________________________________________________________________。
(1)2SO2(g)+O2(g)  2SO3(g) 反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol。请回答下列问题:
2SO3(g) 反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol。请回答下列问题: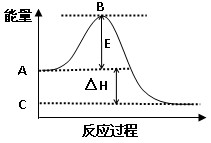
①图中A点表示 ; C点表示 ;E的大小对该反应的反应热 ;(填“有”或“无”)影响。
②图中△H= kJ/mol。
(2)25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,则氢气的燃烧热的化学方程式为 。
(3)①C(s) + O2(g) = CO2(g);ΔH = –393.5kJ/mol
②CO(g) + 1/2 O2(g) = CO2(g);ΔH = –283kJ/mol
根据上述信息,写出C转化为CO的热化学方程式为 。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH)=nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应 ④处于A点的反应体系从T1变到T2,
④处于A点的反应体系从T1变到T2,
达到平衡时增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1KJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式_________________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2+3H2 2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为________。
2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+02(g)=C02(g) △H1=-akJ·mol-1
2H2(g)+02(g)=2H20(l) △H2=-bkJ·mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l) △H3=-ckJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变 :△H=_________。
.化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化。
(1)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为________kJ·mol-1,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1molC2H2(g)的ΔH。
C(石墨)+O2(g)===CO2(g)ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)===2H2O(l)ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH3=-2599.2kJ·mol-1,
则由C(石墨)和H2(g)反应生成1molC2H2(g)的ΔH=________kJ·mol-1。
②已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,并放出XkJ热量。已知单质碳的燃烧热为YkJ·mol-1,则1molC与O2反应生成CO的反应热ΔH为________。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。N-H键的键能是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
(4分)25℃,1.01×10 Pa时8 g甲烷完全燃烧,当恢复至原状态时,放出445 kJ热量,此反应的热化学方程式为:________ ___________.
Pa时8 g甲烷完全燃烧,当恢复至原状态时,放出445 kJ热量,此反应的热化学方程式为:________ ___________.
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列 △ H 表示物质燃烧热的是 (填字母编号)。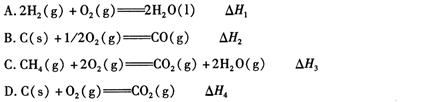
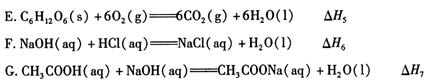
(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为 (其中热效应从上述 △H1 ~△H7尽中选取)。
(3)中和热的测定是高中化学的定量实验之一。 50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是。大烧杯上如不盖硬纸板,求得的中和热数值将会(填“偏大”、“偏小”或“无影响”)。
(8分)已知化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化:
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N键的键能为 kJ·mol-1。根据上图写出N2(g)和O2(g)生成NO(g)的热化学方程式: 。
(2)NO(g)分解生成N2(g)和O2(g)的热化学方程式为: 。
当有16 g O2(g)生成时,该反应中放出的热量为: kJ。
某实验活动小组在实验室进行中和 反应反应热的测定。请回答下列问题:
反应反应热的测定。请回答下列问题:
(1)测定中和反应反应热的实验装置如图所示。在两个烧杯之间填弃碎泡沫塑料的目的是 。
(2)在进行中和反应反应热的测定中,量取50 mL 0.50mol/L的盐酸,倒入小烧杯中,测量盐酸的温度,然后需加入下列 试剂(填序号)
①50mL 0.50mol/L NaOH溶液
②50mL 0.55mol/L NaOH溶液
③1.0g NaOH固体
(3)下述情况会使中和反应反应热的测定结果偏小的是(填序号)
a.用量筒量取50mL 0.50mol/L的盐酸时仰视读数
b.分多次把(2)中所选试剂倒入盛有盐酸的小烧杯中
c.用醋酸代替盐酸
试题篮
()