下列说法正确的是
A.已知: 则可以计算出反应 则可以计算出反应 的ΔH为-384 kJ/mol 的ΔH为-384 kJ/mol |
| B.辛烷的标准燃烧热为-5518 kJ/mol。则辛烷燃烧的热化学方程式可表示为: C8H18(g)+12.5O2(g)= 8CO2(g)+9H2O(g);ΔH=-5518 kJ/mol |
C.2CO(g)+O2(g)=2CO2(g) ;ΔH=-566 kJ/mol 下图可表示该反应过程与能量的关系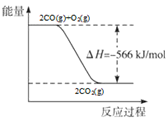 |
| D.S(s)+O2(g)=SO2(g);ΔH1 S(g)+O2(g)=SO2(g);ΔH 2则ΔH1>ΔH2 |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
| A.ΔH3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定 |
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol 。下列说法或表达正确的是:
| A.金刚石比石墨稳定 |
| B.C(s、石墨)=C(s、金刚石)△H =+1.5kJ/mol |
| C.△H1<△H2 |
| D.如果使用催化剂,△H1和△H2都变小 |
如图所示是298 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( ) 
A.该反应的热化学方程式为:N2+3H2 2NH3 ΔH=-92 kJ/mol 2NH3 ΔH=-92 kJ/mol |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热改变 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
已知:N2(g)+3H2(g) 2NH3(g)△H=" —92" kJ/mol,相关数据如下表。一定条件下,在体积为1L的密闭容器中加入1molN2和3molH2充分反应,放出热量Q1kJ,下列说法正确的是( )
2NH3(g)△H=" —92" kJ/mol,相关数据如下表。一定条件下,在体积为1L的密闭容器中加入1molN2和3molH2充分反应,放出热量Q1kJ,下列说法正确的是( )
| |
H2(g) |
N2(g) |
NH3(g) |
| 1mol分子中的化学键形成时要释放出的能量/kJ |
436 |
946 |
a |
A.如图可表示合成氨过程中的能量变化
B.a的数值为391
C.Q1的数值为92
D.相同条件下,反应物若为2molN2和6molH2,放出热量Q2>2Q1
下列关于反应能量的说法正确的是( )
| A.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1, 则反应物总能量>生成物总能量 |
| B.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 |
| C.25 ℃、101 kPa时,2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1, 则H2的燃烧热为571.6 kJ·mol-1 |
| D.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
① H2(g)+I2(?) 2HI(g)+9.48kJ② H2(g)+I2(?)
2HI(g)+9.48kJ② H2(g)+I2(?) 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
| A.①中的I2为固态,②中的I2为气态 |
| B.②的反应物总能量比①的反应物总能量低 |
| C.①的产物比反应②的产物热稳定性更好 |
| D.1mol 固态碘升华时将吸热17kJ |
已知乙炔与苯蒸气完全燃烧的热化学方程式如下:
①C2H2(g)+ O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
②C6H6(g)+ O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
下列说法正确的是 ( )。
| A.1 mol C2H2(g)完全燃烧生成气态水时放热大于1 300 kJ |
| B.1 mol C6H6(l)完全燃烧生成液态水时放热大于3 295 kJ |
| C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多 |
| D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应 |
已知:H2(g)+ O2(g)=H2O(l) ΔH1=-285.8 kJ·mol-1 ①
O2(g)=H2O(l) ΔH1=-285.8 kJ·mol-1 ①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1 ② O2(g)=O2(l) ΔH3=-6.84 kJ·mol-1 ③
H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1 ④
下列说法正确的是
| A.上述四个反应都是吸热反应 |
| B.1 mol液态H2的能量大于1 mol气态H2的能量 |
| C.H2的燃烧热(ΔH)为-285.8 kJ·mol-1 |
D.火箭中液氢燃烧的热化学方程式为H2(l)+ O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 |
下列有关热化学方程式的叙述正确的是( )
| A.在稀溶液中:H+(aq)及+OH-(aq) = H2O(l) ΔH=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.需要加热的反应说明它是吸热反应 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
下列说法正确的是( )
A.如图可表示水分解过程中的能量变化 |
| B.若2C(s)+O2(g)=2CO(g)△H="-221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H="-" a kJ/mol, |
Ⅱ:
且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由C(石墨)=C(金刚石)△H="+1.90" kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中,H+(aq))+OH-(aq))=H2O(l)△H=-57.3 kJ·mol-1,若将含0.5 molH2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2 H2(g)+O2(g)="2" H2O(1)△H=-285.8 kJ·mol-1 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是( )
| A.反应①中的能量变化如右图所示 |
| B.CH3OH转变成H2的过程一定要吸收能量 |
| C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D.可推知2H2(g)+O2(g)=2H2O(g)∆H=-483.8 kJ/mol |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的△H=2×283.0kJ/mol |
已知反应 ①
②稀溶液中,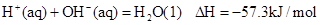 ,下列结论正确的是
,下列结论正确的是
| A.碳的燃烧热为110.5kJ/mol |
| B.2molC(s)+1molO2(g)的能量比2molCO(g)的能量高221kJ |
| C.0.5 molH2SO4(浓)与1 molNaOH溶液混合,产生57.3kJ热量 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量 |
试题篮
()