下面对SO2和CO2的描述正确的是
| A.都是直线形结构 | B.中心原子都采取sp杂化 |
| C.S原子和C原子上都没有孤电子对 | D.SO2为V形结构,CO2为直线形结构 |
下列化合物中既有离子键又有共价键的是
| A.NaOH | B.H2S |
| C.CaCl2 | D.H2O2 |
下列有关化学键与晶体的说法中,不正确的是( )
| A.离子晶体的晶格能越大,离子晶体的熔点越高 |
| B.离子化合物中不一定只含有离子键 |
| C.成键原子的原子轨道重叠越多,共价键越牢固 |
| D.共价键的键能越大,分子晶体的熔、沸点越高 |
下列物质中,既含有离子键又含有非极性键的是
| A.CO2 | B.MgCl2 | C.KOH | D.Na2O2 |
下列关于杂化轨道的叙述中,不正确的是
| A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子 |
| C.[Cu(NH3)4]2+和CH4两个分子中中心原子Cu和C都是通过sp3杂化轨道成键 |
| D.杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾 |
氮是地球上极为丰富的元素。
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N—N单键的键能为193 kJ·mol-1。
计算:N2分子中“π”键的键能约为 ;
结论:N2分子中“σ”和“π”键的稳定性 。
(2)氮的氧化物是大气污染物之一。为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下: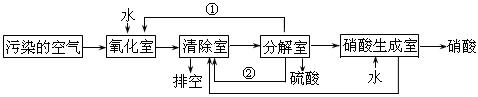
其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4 + H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4 + 4NO2
回答下列问题:
Ⅰ.①和②分别为(写化学式) 、 ;
Ⅱ.氧化室发生的反应是 ;
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3—形成的晶体结构如右图所示。其 中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。
中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。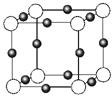
(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下: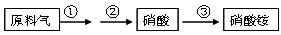
其中反应②为:4NO+3O2+2H2O=4HNO3 原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
Ⅰ.写出反应①的化学方程式 。若不考虑副反应且各步反应均完全,生产过程中原料气中的氨气(不包含第③步被硝酸吸收的氨气)和空气中氧气恰好全部转化为硝酸,则原料气中制备硝酸的氨气和氧气的体积比为 。
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为多少?(写出计算过程)
已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体。组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素。则下列判断正确的是
| A.四种分子中的化学键均是极性键 | B.a、c分子中中心原子均为sp3杂化 |
| C.四种分子中既有σ键,又有π键 | D.b、d分子中共价键的键能b大于d |
下列叙述不正确的是: ( )
| A.干冰变为二氧化碳气体,需吸收能量,是因为共价键被破坏 |
| B.碳酸氢铵是典型离子化合物,其受热分解产生氨气不仅破坏离子键还破坏了共价键 |
| C.化学反应是吸热还是放热决定于反应物和生成物所具有的总能量的相对大小 |
| D.共价化合物中一定只含共价键 |
下列说法中正确的是 ( )
| A.离子化合物中可能含有共价键,共价化合物中可能含有离子键 |
| B.一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3 |
| C.铁质器件附有铜质配件,在接触处易生铁锈 |
| D.非极性共价键只存在于双原子单质分子里 |
初中时我们就知道,有新物质生成的反应属于化学反应,但从化学键的观点看化学反应的实质是“旧键的断裂,新键的形成”。据此你认为下列变化不属于化学反应的是( )
| A.蔗糖溶于水 | B.金刚石变成石墨 |
| C.氯化钠熔化 | D.五氧化二磷吸水 |
现有如下各种说法:
①金属和非金属化合时一定形成离子键
②离子键是阳离子、阴离子的相互吸引力
③根据电离方程式HCl===H++Cl-,判断HCl分子里存在离子键
④H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程
上述各种说法正确的是( )
| A.①② | B.都不正确 |
| C.①②④ | D.① |
下列各组化合物中化学键类型不同的是 
| A.NaCl和HNO3 | B.H2O和 NH3 | C.MgF2和 NaCl | D.H2O和CO2 |
试题篮
()