下列说法正确的是
①含共价键的化合物一定是共价化合物
②气态单质分子中一定含有共价键
③由非金属元素组成的化合物可能是离子化合物
④离子化合物中一定含有离子键
⑤由不同元素组成的多原子分子里,一定只存在极性共价键
| A.②③ | B.②③⑤ | C.③④ | D.①②④ |
原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征,下列各对粒子中,空间结构相似的是( )
①CS2与NO2 ②CO2与N2O ③SO2与O3 ④PCl3与BF3
| A.①②③ | B.③④ | C.②③④ | D.②③ |
Ⅰ.用 表示原子:
表示原子:
(1)阳离子AXn+中共有x个电子,则该阳离子中含有的中子数目为 。
(2)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为 mol。
Ⅱ.有① 、
、 、
、 ②H2、D2、T2 ③石墨、金刚石 ④
②H2、D2、T2 ③石墨、金刚石 ④ 、
、 、
、 四组微粒或物质。
四组微粒或物质。
回答下列问题:
(1)互为同位素的是 (填编号)。
(2)由①和④中微粒结合形成的水分子种类有 种。
Ⅲ.下列物质中:①N2 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥Ne ⑦H2S ⑧KOH ⑨Na2O2 ⑩K2O
只存在共价键的是 ;属于离子化合物,但含有共价键的是 。
(1)请用下列几种物质的序号填空:
①MgCl2 ②Na2S ③NH4NO3 ④K2O2 ⑤Ca(OH)2 ⑥Na2CO3 ⑦SiF4
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y是构成上述物质元素中的两种,能形成XY2型化合物,已知XY2中共有38个电子,若XY2为离子化合物,用电子式表示XY2的形成过程 ;若XY2为共价化合物时,其电子式为____________。
(8分)钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的电子排布式为_____________________;
(2)写出与CO互为等电子体的分子__________________;
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
①TiCl4为______化合物(填“离子”或“共价”)(已知电负性:Ti—1.5,Cl—3.0);
②TiCl4分子为正四面体形,则Ti为________杂化;
③配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 ;
(4)TiCl4在潮湿空气中水解的化学方程式为_____________________________________。
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物的相对分子质量为17,W的质子数是X、Y、Z、M四种元素质子数之和的一半。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
| D.Z元素形成的某种单质有漂白性 |
短周期元素D、E、X、Y、Z原子序数逐渐增大。它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Z的价电子排布式为________________,EZ3分子的空间构型为_____________________;
(2)X与Z构成的分子是_________分子(填“极性”或“非极性”)。
(3)D和Y形成的化合物,其分子中的共价键为__________共价键(填“极性”或“非极性”),该分子中D原子的杂化方式为____________。
(4)写出一个验证Y与Z的非金属性强弱的离子反应方程式_________________________;
(5)金属镁和E的单质在高温下反应得到的产物与水反应生成两种碱性物质,该反应的化学方程式是_________。
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C2- 2与O2+ 2、N2互为等电子体,O2+ 2的电子式可表示为 ;1mol O2+ 2中含有的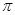 键为 mol。
键为 mol。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 、 。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中有哑铃形的C2- 2存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离相等且最近的C2- 2数目为 。

A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。D是地壳中含量最多的金属元素。E元素为同周期电负性最大的元素。D和E可形成化合物丙。F为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出F基态原子的外围电子排布式 。
(2)B和C比较,第一电离能较大的元素是 (填元素符号)。
(3)甲、乙两分子中含有非极性共价键的是 (填分子式)。
(4)已知化合物丙熔点190℃,沸点183℃,结构如右图所示。

①丙属于 晶体。
②丙含有的作用力有 (填序号)。
A 离子键 B 共价键 C 金属键
D 配位键 E 范德华力
(5)F3+与元素A、C、E构成配合物戊,在含有0. 1mol戊的溶液中加入过量AgNO3溶液,经过滤、洗涤、干燥后,得到28.7g白色沉淀。已知该配合物的配位数为6,则戊的化学式为 。
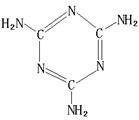
(6)三聚氰胺(结构如右图)由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中N原子的杂化类型是 。
X、Y、Z、R、T、U分别代表原子序数依次增大的短周期主族元素。X元素原子的质子数等于其电子层数;Y的基态原子核外电子有5种不同的运动状态;Z与T同主族且原子序数T是Z的两倍;R元素的原子半径在短周期主族元素中最大。请回答下列问题:
(1)Z的基态原子电子排布式为_______;TZ32-离子的空间构型为_______。
(2)T、U的最高价氧化物对应的水化物酸性由强到弱的顺序为__________(填化学式)。
(3)化合物RU的晶体类型为 ;已知RU晶胞体积为Vcm3,RU的摩尔质量为M g/mol则该晶体密度p= (用含V、M的式子表示)。
(4)将Y2X6气体通人H20中反应生成一种酸和一种单质,该反应的化学方程式是 。(已知:Y的电负性为2.0,X的电负性为2.1)
以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH-④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+⑧[Ag(NH3)2]OH
| A.①④⑥⑦⑧ | B.③④⑤⑥⑦ | C.①④⑤⑥⑦⑧ | D.全部 |
下列说法中不正确的是
①水分子的电子式为 ②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
③氮分子的电子式为 ④只含有离子键的化合物才是离子化合物
④只含有离子键的化合物才是离子化合物
| A.①② | B.③④ | C.①④ | D.②③ |
(Ⅰ)某钠盐溶液中通入足量氨气,无明显现象。再在所得溶液中通入过量CO2,产生大量白色沉淀。
(1)写出氨气的电子式 。
(2)该钠盐溶液中一定不可能含有下列哪种微粒 (填编号)。
| A.Cl- | B.Fe2+ | C.SiO32- | D.AlO2- |
(3)写出一个通入过量CO2时生成白色沉淀的离子方程式 。
(Ⅱ)电镀工业中往往产生大量的有毒废水,必须严格处理后才可以排放。某种高浓度有毒的含A离子(阴离子)废水在排放前的处理过程如下:
已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25g/L的气体1.12L。
(4)沉淀D的化学式是 。
(5)写出沉淀D在氧气中灼烧发生的化学方程式 。
(6)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理 。
(7)反应①为制得某种元素的低价X离子,试从氧化还原反应的角度分析,是否可以用Na2SO3溶液来代替B溶液 ,
并设计实验证明所用Na2SO3溶液是否变质 。
(18分)Ⅰ.(7分)次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性。试回答下列问题:
(1)P的原子结构示意图为 ;
(2)NaH2PO2为 (“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为 。
(3)H3PO2可将溶液中的银离子还原为银单质,若氧化剂与还原剂的物质的量之比为4︰1,则该反应的氧化产物的化学式为 。
Ⅱ.(11分)某无机化合物A的相对分子质量为184。在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7。将18.4gA隔绝空气加强热可得到12.8g B和气体单质C。请回答下列问题:
(1)A的化学式为 ,C的电子式为 。
(2)写出SCl2与氨反应的化学方程式 。
(3)亚硝酸钠和X固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(4)请设计检验物质X的实验方案 。
试题篮
()