北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测得该物质属于离子化合物,且具有良好的超导性,下列关于K3C60的组成和结构的分析正确的是
| A.K3C60中既有离子键,又有极性键 |
| B.K3C60中含有非极性共价键 |
| C.1 mol K3C60中含有的阴离子个数为3×6.02×1023 |
| D.该物质的化学式可写成KC20 |
已知A、B、C、D、E五种主族元素分别位于第1、2、3周期,原子序数依次增大,其中A与C、B与D分别同主族,且B原子的最外层电子数等于A与C原子序数之和的一半,下列叙述正确的是
A.原子半径:A<B<C<D<E
B.D、E的气态氢化物的热稳定性:D>E
C.A与B、C与B均能形成X2Y2型化合物,且其中所含有的化学键类型相同
D.另外四种元素能够分别与C形成含单原子核阴离子的离子化合物
关于化学键的下列叙述中,正确的是
| A.离子化合物中可能含离子键 | B.共价化合物中可能含离子键 |
| C.离子化合物中不含共价键 | D.共价化合物中不含离子键 |
最近,科学家在甲烷的低温活化与二氧化碳加氢研究上取得了突破,其反应原理如下: 。下列说法错误的是
。下列说法错误的是
| A.CO2、CH3COOH均为共价化合物 |
| B.每生成1molCH3COOH,要消耗22.4LCO2 |
| C.CO2、CH3COOH分子中均含σ键和π键 |
D. 属于氧化反应 属于氧化反应 |
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物
| A.所含共用电子对数目为(a/7+1)NA | B.所含碳氢键数目为aNA/7 |
| C.燃烧时消耗的O2一定是33.6a/14 L | D.所含原子总数为aNA/14 |
酚酞是中学阶段常用的酸碱指示剂,结构简式如图所示:下列关于酚酞的说法错误的是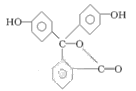
| A.酚酞与水可以形成氢键 |
| B.酚酞的分子式为C20H14O4 |
| C.酚酞结构中含有羟基(—OH),故酚酞属于醇 |
| D.酚酞在一定条件下能够发生加成反应 |
下列化学用语的书写,正确的是
A.氯原子的结构示意图: |
| B.6个质子8个中子的碳元素的核素符号:12C |
C.氯化镁的电子式: |
D.用电子式表示氯化氢的形成过程:  |
将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用
①共价键 ②离子键 ③分子间作用力,正确的顺序是
| A.①②②③ | B.②①②③ | C.②③②① | D.①①②③ |
下图是常温下,部分短周期元素最高价氧化物对应水化物的等物质的量浓度稀溶液的pH值与原子序数的关系图,Z的氧化物是两性氧化物。下列说法正确的是
| A.L对应的氢化物比E对应的氢化物更稳定、熔沸点更高的原因是L的氢化物可以形成两种化学键 |
| B.W、R两种元素的最高价氧化物对应的水化物的pH后者较大 |
| C.元素E、W对应的单质,其晶体类型可能相同、也可能不同,这是由于它们形成晶体的化学键类型不同造成的 |
| D.元素X、Y、W形成的化合物溶液可能能与W的最高价氧化物反应,既生成沉淀,又产生气体 |
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
| A.工业上常用电解的方法制备W的单质 |
| B.元素Z的简单气态氢化物的热稳定性比Y的强 |
| C.仅由X、Y、Z三种元素形成的化合物的水溶液一定呈碱性 |
| D.化合物X2Z2与W2Z2所含化学键类型完全相同 |
C60可用作储存氢气的材料,结构如图所示。继C60后,科学家又合成了Si60、N60,三种物质结构相似。下列有关说法正确的是
| A.C60、Si60、N60都属于原子晶体 |
| B.C60、Si60、N60分子内共用电子对数目相同 |
C.由于 键能小于 键能小于 ,故N60的稳定性弱于N2 ,故N60的稳定性弱于N2 |
D.由于 键长小于 键长小于 键,所以C60熔沸点低于Si60 键,所以C60熔沸点低于Si60 |
同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物 PH4I是一种白色晶体,下列对它的描述中正确的是
| A.它是一种共价化合物 |
| B.在加热时此化合物可以分解为PH3和HI |
| C.这种化合物不能跟碱反应 |
| D.该化合物中只含有共价键 |
下列说法正确的是
①一块冰中氢、氧原子间只以化学键相结合
②金属和非金属化合形成离子键
③离子键是阳离子、阴离子的相互吸引
④双原子单质分子中的共价健一定是非极性键
⑤非金属原子间不可能形成离子键
⑥离子化合物中可能有共价键
⑦共价化合物中可能有离子键
⑧两种不同非金属元素形成的共价化合物中只有极性键
| A.④⑥ | B.②④⑤ | C.①②③ | D.④⑥⑧ |
试题篮
()