某些共价键的键能数据如下(单位:kJ/mol)
| 共价键 |
H-H |
Cl-Cl |
Br-Br |
H-Cl |
H-I |
I-I |
N≡N |
H-O |
H-N |
| 键 能 |
436 |
247 |
193 |
431 |
299 |
151 |
946 |
463 |
391 |
(1)把1molCl2分解为气态原子时,需要 (填“吸收”或“放出”) kJ能量。
(2)试通过键能数据估算H2(g)+Cl2(g)=2HCl(g)反应中的能量变化:(填“吸收”或“放出”) kJ能量。
在①Ar ②干冰③SiO2 ④NH4Cl ⑤K2S⑥金刚石六种物质,按下列要求回答(填序号)
⑴只存在共价键的是 ,既存在离子键,又存在共价键的是 ;
⑵熔化时不需破坏化学键的是 ,熔化时需要破坏共价键的是 ;
⑶写出①的电子式是 ,④的电子式是 。
有:①11H、21H、31H ②H2、D2、T2③石墨、金刚石④正丁烷和异丁烷四组微粒或物质,回答下列问题:(填序号)
(1)互为同素异形体的是_______;(2)互为同分异构体的是__________
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为 。请回答下列问题:
。请回答下列问题:
(1)B元素是____________,D元素在周期表中的位置是_____________________;
(2)C与E形成的化合物E3C属于________晶体(填“原子”、“离子”或“分子”);
(3)由A、D、E元素组成的化合物中存在的作用力是_________________________;
(4)写出一个E和D形成的化合物与水反应的离子方程式_______________________;
(5)已知:甲 + H2O → 丙 + 丁。若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的电子式为 。 
(6)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,三种元素氢化物沸点由大到小的顺序是(填写化学式) 。
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大。其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g·L—1,C元素原子的最外层电子数是其内层电子数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):
其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、
丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应。请回答下列问题:
(1)写出化合物甲的电子式: 。
(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式 ;
写出均含有F元素的乙与丁在溶液中发生反应的离子方程式 。
(3)由A、C元素组成化合物的戊和A、E元素组成的化合物己,式量均为34。其中戊的熔沸点高于己,其原因是: 。
(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐。请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式 。该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体。写出相关反应的化学方程式 ,析出该复盐晶体的原理是 。
现有下列物质, 用编号填空回答下列问题:(每空各2分多选错选不得分)
| A.干冰 | B.金刚石 | C.氩 | D.过氧化钠 E.二氧化硅 F. 溴化铵 |
(1)通过非极性键形成的原子晶体是: 。
(2)可由原子直接构成的分子晶体是: 。
(3)含有离子键、共价键、配位键的化合物是: 。
(4)含有非极性键的离子化合物是: 。
氯化铍是用于制有机铍化合物和金属铍的重要原料。
(1)BeCl2分子中组成元素Be的基态原子的价电子排布式为 ,其元素的第一电离能 B元素(填“>”或“<” 或“=”),原因是 。
(2)已知BeCl2加热易升华,液态BeCl2不导电,BeCl2晶体类型为 ; BeCl2中Be原子的杂化轨道类型是 。
(3)用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子达到8电子稳定结构,则该离子内存在的微粒间的作用力是 ,阴离子的结构式为 。
(8分)填写下列空白(填序号):
①CH4 ②CH2==CH2 ③CH CH ④NH3 ⑤NH4+⑥BF3 ⑦P4
CH ④NH3 ⑤NH4+⑥BF3 ⑦P4
⑧H2O ⑨H2O2 ⑩ SO2 ⑾PCl3 ⑿SO3 ⒀HCHO ⒁CO2
(1) 呈正四面体的是________。
(2) 属于极性分子且中心原子轨道为sp3杂化的是__________________________,
属于非极性分子且中心原子轨道为sp2杂化的是___________,为sp杂化的是________。
(3) 所有原子共平面的是______________,共线的是______________。
(4) 微粒存在配位键的是________。(5)含有极性键的极性分子是________。
(4分)氮可以形成多种离子,如N3-、NH、N、NH、N2H、N2H等,已知N2H与N2H是由中性分子结合质子形成的,类似于NH,因此有类似于NH的性质。
(1) NH的电子式为____________。(2)N有______个电子。
(3)写出两种由多个原子组成的含有与N电子数相同的物质的化学式__________。
(4)等电子数的粒子往往具有相似的结构,试预测N的空间构型________________。
现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1。B的阳离子的电子层结构与Ne原子相同,2gB的氧化物与100ml 0.5mol/L的 恰好完全反应。B单质与D单质反应后可形成离子化合物
恰好完全反应。B单质与D单质反应后可形成离子化合物 ;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
(1)五种元素的名称是B________;D ;E________.
(2) 形成化合物 的化学键类型是: .
的化学键类型是: .
(3)用电子式表示化合物BD2的形成过程。 .
(4) A的氢氧化物的水溶液和C单质发生反应的离子方程式: .
甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。
(1)甲硅烷中含有的化学键是_________ ,其在固态时属于______晶体。
(2)已知室温下1 g甲硅烷自燃生成SiO2和水放出热量44.6 kJ,则其热化学方程式为_________ 。
在下列化合物中:① H2O,② Na2O,③ I2,④ NaCl,⑤ KOH,⑥ CO2,⑦ NH4Cl,⑧Na2O2,请填空(用序号表示):
(1)只由非金属组成的离子化合物是 ,
(2)含有极性共价键的离子化合物是 ,
(3)只含有非极性共价键的是 ,
(4)既有离子键又有非极性键的化合物是 。
现有①MgBr2 ②金刚石 ③NaOH ④KCl ⑤干冰五种物质,按下列要求回答(填序号,每空一个答案)
(1)是共价化合物的是______,既有离子键又有共价键的物质是
(2)熔化时不需要破坏化学键的是____ ____,熔化时需要破坏共价键的是____ ____,熔点最高的是____ ____。
下列物质①铁 ②干冰 ③金刚石 ④铜 ⑤水晶 ⑥氯化钠 ⑦单质碘⑧氢氧化钠【请用编号回答(1)和(2)小题】
(1)属于离子晶体的是 ,属于分子晶体的是 ,属于原子晶体的是 ,属于金属晶体的是 ;
(2)只含共价键(不含分子间作用力)的化合物是 ,只含离子键的是 ,既含共价键又含离子键的是 ;
(3)写出电子式:干冰 ,氢氧化钠 。
(4)写出结构式:干冰 ,单质碘
原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1。请回答下列问题:
(1)这四种元素中电负性最大的是 (填元素符号)、第一电离能最小的是 (填元素符号)
(2)C所在的主族元素气态氢化物中,沸点最低的是 (填化学式)
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为 ;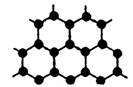
(4)D的水合醋酸盐晶体局部结构如右图,该晶体中含有的化学键是 (填选项序号);
①极性键 ②非极性键 ③配位键 ④金属键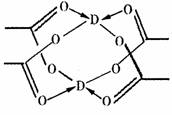
试题篮
()