下列说法或表述正确的是
| A.由水电离产生的c(H+)=1×10-2mol•L-1溶液中,可能存在:CO32-、NH4+、Cl-、Na+ |
| B.某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| C.Ba(OH)2溶液中加人过量的Al2(SO4)3溶液,其离子方程式为: 3Ba2++6OH- +2Al3++3SO42-=3BaS04↓+2Al(OH)3↓ |
| D.物质的量浓度均为1 mol•L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA(NA表示阿伏加德罗常数的值) |
关于电解质溶液下列说法中不正确的是
A.向浓度均为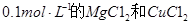 混合溶液中逐滴加入氨水,先生成蓝色 混合溶液中逐滴加入氨水,先生成蓝色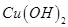 沉淀,则 沉淀,则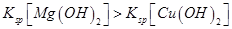 |
| B.用等浓度的NaOH溶液中和等体积pH=2与pH=3的醋酸,所消耗的NaOH溶液的体积前者是后者的10倍 |
C.由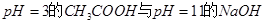 溶液等体积混合,其离子浓度的顺序为: 溶液等体积混合,其离子浓度的顺序为: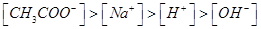 |
D.某温度下纯水中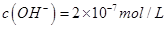 ,则该温度下0.1mol/L的盐酸的pH=1 ,则该温度下0.1mol/L的盐酸的pH=1 |
常温下体积相同的下列四种溶液:①pH=3的盐酸 ②pH=3的醋酸溶液 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法中,正确的是
| A.②和④混合,所得混合溶液的pH大于7 |
| B.将四种溶液分别稀释到体积为原的100倍,溶液pH大小顺序③>④>②>① |
| C.③和④分别与足量稀硫酸中和,消耗硫酸的体积③=④ |
| D.①和③混合,所得混合溶液中c(H+)+ c(NH4+)=c(Cl-)+c(OH-) |
向20mL 0.5mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是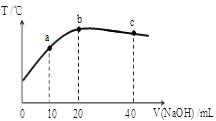
| A.醋酸的电离平衡常数:b点>a点 |
| B.由水电离出的c(OH—):b点>c点 |
| C.从a点到b点,混合溶液中可能存在:c(CH3COO—)= c(Na+) |
| D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO—)>c(OH—)>c(H+) |
下列说法正确的是
A.常温下在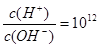 的溶液中能大量共存的离子组:Na+、NO3-、I-、SO42- 的溶液中能大量共存的离子组:Na+、NO3-、I-、SO42- |
| B.ALCL3溶液与过量氨水反应的离子方程式为:Al3++4OH-=[Al(OH)4]- |
| C.某温度下的醋酸铵溶液呈中性,则溶液中:c(H+)=c(OH-)=10-7mol·L-1 |
| D.0.1mol·L-1的NaHSO3溶液中:c(HSO3-)+C(SO32-)+c(H2SO3)=0.1mol·L-1 |
下列关于常温下电解质溶液的叙述中,正确的是
| A.碳酸氢按溶液和足量氢氧化钠溶液混合,反应的离子方程式为:HCO- 3+OH-=CO2- 3+H2O |
| B.25℃时,pH=8的0.lmol·L-1NaX溶液中由水电离出的c(OH-)=1×10-8mol·L-1 |
| C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液中,c(NH+ 4)前者小于后者 |
| D.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH+ 4)=c(Cl-)+c(OH-) |
25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.a mol·L-1HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.0.1 mol·L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
常温下,实验室有0.01mol•L-1醋酸,下列叙述正确的是
| A.c (CH3COO-) + c (OH-)=" 0.01" mol•L-1 |
| B.与等体积pH = 12的氨水混合后所得溶液显碱性 |
| C.加入少量醋酸钠固体后所得溶液中c (CH3COO-)减小 |
| D.与等体积0.01 mol•L-1NaNO3溶液混合后有:c (NO3-) =" c" (CH3COO-)+c (CH3COOH) |
下列说法正确的是
| A.常温下,pH = 7的氨水与氯化铵的混合溶液中:c(Cl-) = c(NH4+) |
| B.常温下pH = 5的盐酸溶液稀释1000倍后pH = 8 |
| C.在BaSO4的饱和溶液中加入一定量Na2SO4固体,BaSO4的溶解度和Ksp均变小 |
| D.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
| A.醋酸溶液中:c(H+)>c(CH3COO-)>c(OH-) |
| B.NaHCO3溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) |
| C.等体积、等物质的量浓度的醋酸与氢氧化钠溶液混合:c(Na+)=c(CH3COO-) |
| D.中和等体积、等物质的量浓度的CH3COOH溶液和HCl溶液所消耗的NaOH物质的量相等 |
下列叙述正确的是
| A.0.1 mol·L-1醋酸溶液中:c(H+)= c(CH3COO-)+c(OH-) |
| B.中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 |
| C.同温度同浓度的NaOH和澄清石灰水中,水的电离程度相同 |
| D.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+) |
室温时,0.1 mol·L-1的HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,有关叙述正确的是
| A.原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B.当滴入少量的NaOH,促进了HA的电离,溶液的pH降低 |
| C.当恰好完全中和时,溶液呈中性 |
| D.当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
下列叙述正确的是
| A.相同温度下,中和pH=1的盐酸和醋酸各20.0mL,需要0.100 mol·L-1NaOH都是20.0mL |
| B.0.1mol·L-1Na2CO3中加入少量NaOH固体后振荡,c(Na+)和c(CO32-)都增大 |
| C.常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
| D.相同浓度的CH3COOH和 CH3COONa溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
常温下,实验室有0.01mol·L-1醋酸,下列叙述正确的是
| A.c (CH3COO-) + c (OH-)=" 0.01" mol·L-1 |
| B.与等体积pH = 12的氨水混合后所得溶液显碱性 |
| C.加入少量醋酸钠固体后所得溶液中c (CH3COO-)减小 |
| D.与等体积0.01 mol·L-1NaNO3溶液混合后有:c (NO3-) =" c" (CH3COO-)+c (CH3COOH) |
常温下,下列有关叙述正确的是
A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: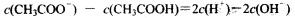 |
B.Na2CO3溶液中,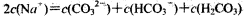 |
C.pH相等的CH3COONa、NaClO、NaHCO3三种溶液: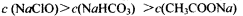 |
D.NH4Cl溶液和NaOH溶液混合所得的中性溶液中: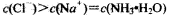 |
试题篮
()