下列对各种平衡体系的叙述中,完全正确的一组是
①在醋酸溶液中存在的电离平衡:CH3COOH CH3COO-+ H+加水稀释后,溶液中所有离子浓度均减小;
CH3COO-+ H+加水稀释后,溶液中所有离子浓度均减小;
②常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡逆向移动;
③一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:
CH3COO- +H2O CH3COOH+OH-,使得溶液中的c(OH—)>c(H+);
CH3COOH+OH-,使得溶液中的c(OH—)>c(H+);
④某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s) △H>0, 平衡后,升高温度,c(z)增大;
2Z(g)+W(s) △H>0, 平衡后,升高温度,c(z)增大;
⑤在上述④的可逆反应中,当容器中气体压强不变时,反应达到平衡;
⑥在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动;
⑦在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
| A.①②③④⑤ | B.②③④⑥⑦ | C.②③⑤⑥⑦ | D.①②⑤⑥⑦ |
下列叙述中正确的是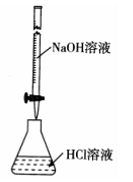
| A.根据上图,若滴定前仰视读数,滴定终点时俯视读数,则测定的盐酸浓度偏高 |
| B.25℃时,难溶物XY和AB3的KSP分别为1.0×10-10和2.7×10-15,则饱和溶液中C(X+)一定大于C(A3+) |
| C.每个Fe(OH)3胶体粒子含一个氢氧化铁分子 |
| D.某溶液中存在K+、HCO-3、CO2-3、OH-、H+,其离子浓度大小顺序可能为c(K+)>c(HCO-3)>c(H+)>c(CO32-) |
下列叙述正确的是
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B. |
25℃时,等体积等浓度的硝酸与氨水混合后,溶液
|
| C. |
25℃时,0.1
|
| D. |
0.1
|
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为。
(2)25℃,在0.10-1
溶液中,通入
气体或加入
固体以调节溶液
,溶液
与
(
-)关系如图(忽略溶液体积的变化、
的挥发)。
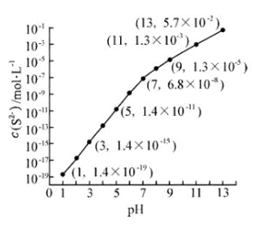
①pH=13时,溶液中的(
)+
(
-)=
-1.
②某溶液含0.020 -1
2+、0.10
-1
,当溶液
= 时,
2+开始沉淀。
[已知:(
)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
| Ka1 |
Ka2 |
|
| H2SO3 |
1.3×10-2 |
6.3×10-4 |
| H2CO3 |
4.2×10-7 |
5.6×10-11 |
①HSO3-的电离平衡常数表达式= 。
②0.10 -1
溶液中离子浓度由大到小的顺序为 。
③溶液和
溶液反应的主要离子方程式为。
升高温度,下列常数中不一定增大的是
| A.平衡常数K | B.电离常数Ka |
| C.水的离子积常数Kw | D.盐的水解常数Kh |
下列关于电解质溶液中离子关系的说法正确的是
| A.0.1mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) |
| D.常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 |
下列溶液或浊液中,关于离子浓度的说法正确的是
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-) > c(HCO3-),且2c(Na+)=3[c(CO32-)+c(HCO3-)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-) = c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
根据水溶液中存在的平衡关系,判断下列说法正确的是
| A.往水中滴加少量稀硫酸,能促进水电离 |
| B.室温下,稀释0.1mol·L-1的醋酸,溶液中所有离子的浓度均降低 |
| C.往AgCl悬浊液中加入0.1mol·L-1Na2S溶液,有黑色沉淀产生 |
| D.浓度均为0.1 mol·L-1的溶液,pH由大到小排列顺序为:NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaS04的Ksp=c(Ba2+)·c(SO42-),所以在BaS04溶液中有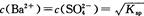
③将O.1 mol/l的NaHS溶液和O.1 mol/lNa2S溶液等体积混合,所得溶液中有2c(OH-)+c(S2-)= 2c(H+)+ c(HS-)+3 c(H2S);
④在O.1 mol/l氨水中滴加O.1 mol/l盐酸,刚好完全中和时pH=a,则由水电离产生的c (OH-)=10-amol·L-1
| A.①④ | B.②③ | C.③④ | D.①② |
下列说法符合事实的是
| A.常温下由水电离产生的c(H+)=10-12mol/L的溶液中加入铝粉都能够产生氢气 |
| B.已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12。在含Cl—、CrO42—浓度相同的溶液中滴加几滴稀AgNO3溶液时,则先生成AgCl沉淀 |
| C.电解硫酸铜溶液一段时间后,加入氧化铜固体不可能使溶液恢复到原来的浓度 |
| D.在NaAlO2和Na2CO3的混合溶液中逐滴滴加盐酸直至过量,开始没有沉淀,随后产生沉淀,最后沉淀消失 |
下列有关溶液的说法正确的是
| A.向10 mL pH=3的醋酸溶液中加入10 mL pH=11的NaOH溶液,混合液的pH=7 |
| B.实验测定,NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>H2CO3 |
| C.NH4Cl溶液加水稀释过程中c(H+)+c(NH3·H2O)=c(OH-) |
| D.向AgI沉淀中加入饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶 |
下列说法正确的是( )
A.向Na2CO3溶液通入CO2,可使水解平衡:CO32-+H2O HCO3-+OH-向正反应方向移动,则溶液pH增大 HCO3-+OH-向正反应方向移动,则溶液pH增大 |
| B.室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 |
| C.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| D.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH值 |
一定条件下,下列说法正确的是
| A.常温时,把pH=1的醋酸溶液稀释10倍后,其pH=2 |
| B.常温时,向CaCO3的饱和溶液中加入Na2CO3固体,则CaCO3的溶度积常数增大 |
| C.向氨水中加入氯化铵固体,会使溶液的pH减小 |
| D.稀释Na2CO3溶液,溶液中c(OH—)增大 |
电导率可用于衡量电解质溶液导电能力的大小,且电导率越大溶液的导电能力越强。室温下 ,用0.l00 mol·L-1的NH3· H2O 滴定10 .00mL 浓度均为0 . 100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。下列说法正确的是
| A.① 溶液中c(H +)为0 . 200 mol·L-1 |
| B.溶液温度高低为① >③ >② |
| C.③ 点后因离子数目减少使电导率略降低 |
| D.③ 点时溶液中有c ( C1一)>(CH3 COO一) |
试题篮
()