下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液c(Na+)=c(NO3-) |
室温下,下列叙述正确的是(溶液体积变化忽略不计) ( )
| |
① |
② |
③ |
④ |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| pH |
11 |
11 |
3 |
3 |
A.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
B.在①、②中分别加入氯化铵固体,两溶液的pH均增大
C.①、④两溶液等体积混合,所得溶液中c(C1-)> c (NH )> c (OH一)> c (H+)
)> c (OH一)> c (H+)
D.②、③两溶液混合,若所得溶液的pH=7,则c (CH3COO一)> c (Na+)
室温下,将1.00mol· L-1盐酸滴入20.00mL1.00mol· L-1氨水中,溶液pH随加入盐
酸体积变化曲线如图所示。下列有关说法正确的是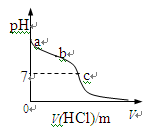
| A.a点:pH=14 |
| B.b点:c(NH4+) +c(NH3·H2O) = c(Cl-) |
| C.c点:水电离出的c(H+) = 1.0×10-7mol· L-1 |
| D.c点后,溶液中离子浓度大小关系一定为: |
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
下列溶液中微粒的物质的量浓度关系正确的是 ( )
| A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性: c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.25℃时,pH =4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合液: c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合: c(HCOO-)+c(H+)<c(Na+)+c(OH-) |
| D.0.1 mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合: |
2 c (CO32-)+2 c (HCO3-)+2 c (H2CO3)="3" c (Na+)
下列叙述错误的是
| A.从FeCl3固体出发配制其溶液时,应先将FeCl3固体溶解在一定浓度的盐酸溶液中,然后再稀释到所需要的浓度 |
B.Al3+的水解方程式为 Al3+ + 3H2O Al(OH)3 + 3H+ Al(OH)3 + 3H+ |
| C.NaHSO4在水溶液中的电离方程式为 NaHSO4 =" Na+" + H+ + SO42- |
| D.H2CO3的电离方程式为 H2CO3 =" H+" + HCO3- |
将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液有关微粒的浓度关系正确的是
A c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B c (Ac-)>c (Cl-)>c (HAc)>c(H+)
C c (Ac-)=c (Cl+)>c (H+)>c (HAc)
D c (Na+)+c (H+)=c (Ac-)+c (OH-)
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)= 0时,c(H+)="1" × 10-2 mol/L |
| B.V(NaOH)< 10 mL时,不可能存在c(Na+)=" 2" c(C2O42-)+ c(HC2O4-) |
| C.V(NaOH)=" 10" mL时,c(H+)="1" × 10-7mol/L |
| D.V(NaOH)> 10 mL时,c(Na+)> c(C2O42-)>c(HC2O4-) |
下列各选项中所述的两个量,前者一定大于后者的是( )
A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数 0.1 mol/L CH3COOH溶液中的H+数 |
| B.pH=1的CH3COOH溶液和盐酸的物质的量浓度 |
| C.pH=12的氨水和NaOH溶液的导电能力 |
| D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积 |
下列有关实验原理或实验操作正确的是 ( )
| A.用pH试纸测定氯水的pH |
| B.过滤时为了加快过滤速度,可以用玻璃棒小心搅拌 |
C.选择合适的试剂,用右图所示装置可分别制取少量CO2和O2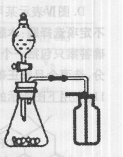 |
| D.室温下向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,可除去苯中少量苯酚 |
下列化学原理表述正确的是 ( )
| A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大 |
| B.同体积同pH的盐酸和醋酸与足量的锌反应,醋酸的反应速率快,生成H2的物质的量多 |
C.NaHCO3溶液不显中性的原因:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.Na2CO3溶液中满足:2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3) |
下列溶液中c(Cl-)与50 mL 1mol/L 的AlCl3溶液中氯离子浓度相等的是
A.150 mL 1mol/L NaCl溶液 |
B.75 mL 2mol/L NH4Cl溶液 |
| C.75 mL 1mol/L FeCl3溶液 | D.150 mL 2mol/L MgCl2溶液 |
下列物质中属于强电解质且能导电的是
①氢氧化钠溶液 ②硫酸钙固体 ③铜 ④蔗糖 ⑤三氧化硫 ⑥熔融氯化钠
| A.①②⑤ B.①②⑥ C.③⑥ D.⑥ |
下列说法中正确的是( )
| A.二氧化硫溶于水能导电,故二氧化硫属于电解质 |
| B.硫酸钡难溶于水,故硫酸钡属于弱电解质 |
| C.硫酸是强电解质,故纯硫酸能导电 |
| D.相同条件下,氢离子浓度相同的盐酸和醋酸导电能力相同 |
下列叙述正确的是( )
| A.可以根据PbI2和AgCl的Ksp的大小比较两者的溶解能力 |
| B.常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大 |
| C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大 |
| D.能使碘化钾淀粉试纸变蓝的溶液中,Na+、S2-、Br-、NH4+等离子可以大量共存 |
试题篮
()