下列有关实验原理或实验操作正确的是 ( )
| A.用pH试纸测定氯水的pH |
| B.过滤时为了加快过滤速度,可以用玻璃棒小心搅拌 |
C.选择合适的试剂,用右图所示装置可分别制取少量CO2和O2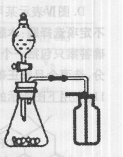 |
| D.室温下向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,可除去苯中少量苯酚 |
下列化学原理表述正确的是 ( )
| A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大 |
| B.同体积同pH的盐酸和醋酸与足量的锌反应,醋酸的反应速率快,生成H2的物质的量多 |
C.NaHCO3溶液不显中性的原因:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.Na2CO3溶液中满足:2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3) |
Mg(ClO3)2在农业上常用作脱叶剂、催熟剂,可采用复分解反应制备:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。下列叙述正常的是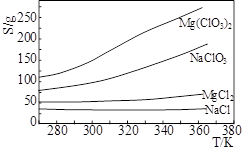
| A.四种化合物的溶解度随温度变化最小的是Mg(ClO3)2 |
| B.300K时,MgCl2的溶解度约为55g |
| C.300K时,100gNaCl饱和溶液中约含有NaCl 36g |
| D.该反应能够进行的条件是生成沉淀,该沉淀是Mg(ClO3)2 |
下列物质属于电解质的是()
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥盐酸 ⑦乙酸
⑧NH3·H2O ⑨三氧化硫
| A.①②⑥⑧ | B.②⑤⑦⑧ | C.②⑤⑥⑦ | D.②④⑤⑨ |
室温下,将1.00mol· L-1盐酸滴入20.00mL1.00mol· L-1氨水中,溶液pH随加入盐
酸体积变化曲线如图所示。下列有关说法正确的是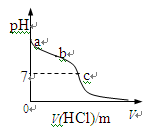
| A.a点:pH=14 |
| B.b点:c(NH4+) +c(NH3·H2O) = c(Cl-) |
| C.c点:水电离出的c(H+) = 1.0×10-7mol· L-1 |
| D.c点后,溶液中离子浓度大小关系一定为: |
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
下列溶液中c(Cl-)与50 mL 1mol/L 的AlCl3溶液中氯离子浓度相等的是
A.150 mL 1mol/L NaCl溶液 |
B.75 mL 2mol/L NH4Cl溶液 |
| C.75 mL 1mol/L FeCl3溶液 | D.150 mL 2mol/L MgCl2溶液 |
下列溶液中微粒的物质的量浓度关系正确的是 ( )
| A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性: c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.25℃时,pH =4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合液: c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合: c(HCOO-)+c(H+)<c(Na+)+c(OH-) |
| D.0.1 mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合: |
2 c (CO32-)+2 c (HCO3-)+2 c (H2CO3)="3" c (Na+)
下列说法中正确的是( )
| A.二氧化硫溶于水能导电,故二氧化硫属于电解质 |
| B.硫酸钡难溶于水,故硫酸钡属于弱电解质 |
| C.硫酸是强电解质,故纯硫酸能导电 |
| D.相同条件下,氢离子浓度相同的盐酸和醋酸导电能力相同 |
下列叙述正确的是( )
| A.可以根据PbI2和AgCl的Ksp的大小比较两者的溶解能力 |
| B.常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大 |
| C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大 |
| D.能使碘化钾淀粉试纸变蓝的溶液中,Na+、S2-、Br-、NH4+等离子可以大量共存 |
下列物质中属于强电解质且能导电的是
①氢氧化钠溶液 ②硫酸钙固体 ③铜 ④蔗糖 ⑤三氧化硫 ⑥熔融氯化钠
| A.①②⑤ B.①②⑥ C.③⑥ D.⑥ |
标准状况下, VL氨气溶解在1L水中(水的密度近似为1g/cm3),所得溶液的密度为ρg/ cm3, 质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是( )
| A.ω=17c/(1000ρ) | B.c=1000Vρ/(17V+22400) |
| C.ω=17V/(17V+22400) | D.ρ=(17V+22400)/(22.4+22.4V) |
将pH=3的盐酸和pH=11的氨水等体积混合,完全反应后,溶液中离子浓度关系正确的是 ( )
| A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B.c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
36.5gHCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c mol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
| A.所得溶液的物质的量浓度:HCl=1mol/L |
| B.所得溶液中含有NA个HCl分子 |
| C.常温下,36.5g HCl气体占有的体积一定为22.4L |
| D.所得溶液的质量分数:ω=36.5c/(1000ρ) |
下列叙述正确的是( )
| A.水的离子积Kw随温度.外加酸(碱)浓度的改变而改变 |
| B.能自发进行的化学反应,一定是ΔH<0.ΔS>0 |
| C.当弱电解质电离成离子的速率与离子结合成分子的速率相等时达到电离平衡状态 |
| D.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中的离子浓度有关 |
试题篮
()