已知:H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8;H2CO3的Ka1=4.2×10-7,Ka 2=5.6×10-11。现将标准状况下2.24L的CO2和2.24L的SO2分别通入两份150mL1mol/LNaOH溶液中,关于两溶液的比较下列说法正确的是
| A.c(HCO3-)<c(CO32-) |
| B.两溶液都能使酸性高锰酸钾溶液褪色 |
| C.c(HCO3-)>c(HSO3-) |
| D.c(CO32-)+c(HCO3-)=c(SO32-)+c(HSO3-) |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+) = c(NO3-) |
| B.1.0 mol·L-1Na2CO3溶液:c(OH-) = c(HCO3-) + c(H+) |
| C.1.0 mol·L-1 NH4Cl溶液:c(NH4+) = c(Cl-) |
| D.醋酸钠溶液:c(Na+) >c(CH3COO-)>c(H+)>c(OH-) |
已知:H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8;H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11。现将标准状况下2.24L的CO2和2.24L的SO2分别通入两份150mL1mol/LNaOH溶液中,关于两溶液的比较下列说法正确的是
| A.c(HCO3-)<c(CO32-) |
| B.两溶液都能使酸性高锰酸钾溶液褪色 |
| C.c(HCO3-)>c(HSO3-) |
| D.c(CO32-)+ c(HCO3-)=c(SO32-)+ c(HSO3-) |
下列有关溶液中离子浓度的关系,不正确的是
| A.NaHCO3溶液中存在:c(OH-)=c(H2CO3)+c(H+) |
| B.常温下,pH=3的盐酸和pH=ll的氨水等体积混合后,溶液中:c(NH4+)>c(Cl-) |
| C.0.2 mol/LNH4Cl溶液与0.1 mol/L NaOH溶液等体积混合后,溶液中:c(NH4+)>c(Na+) |
| D.0.2 mol/L 的 CH3COOH 溶液中c(H+)小于0.1 mol/L 的 CH3COOH 中c(H+)的两倍 |
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表达不正确的是
| A.在NaHCO3溶液中加入与其等物质的量的NaOH ,溶液中的阴离子只有CO32-和OH- |
| B.NaHCO3溶液中:c(HCO3- ) +c(H2CO3) +c(CO32-)=c(Na+) |
| C.相同温度下,l0mL 0.lmol·L-1的醋酸与100mL 0.01 mol·L-1的醋酸中H+的物质的量不相等 |
| D.相同温度下,中和体积与pH都相同的HCI溶液和CH3COOH溶液所消耗的NaOH的物质的量,后者多 |
关于溶液的下列说法正确的是
| A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
C.往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中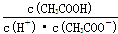 增大 增大 |
| D.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① |
常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HCl的物质的量浓度 (mol·L-1) |
BOH的物质的量浓度 (mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=5 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.1 |
0.2 |
pH>7 |
请回答:
(1)从第①组情况分析,BOH是 (选填“强碱”或“弱碱”)。该组所得混合溶液中由水电离出的
c(OH—)= mol·L-1。
(2)第②组情况表明,c 0.2。该混合液中离子浓度c(B+) c(Cl—)(选填“<”、“>”或“=”)。
(3)从第③组实验结果分析,混合溶液中 (选填“<”、“>”或“=”)
甲:BOH的电离程度 BCl的水解程度
乙:c(B+)—2 c (OH—) c(BOH)—2 c(H+)
下列溶液中各微粒的浓度关系正确的是
| A.物质的量浓度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液, c (NH4+)的大小顺序为:①>②>③ |
| B.pH相等的NaF与CH3COOK溶液:c(Na+)-c(F —)>c(K+)-c(CH3COO—) |
| C.0.2 mo1·L —1的Na2CO3溶液:c(OH—)=c(HCO3—)+c(H+)+2c(H2CO3) |
| D.0.2 mo1·L —1 HCl与0.1 mo1·L —1 NaAlO2溶液等体积混合:c(Cl—)> c(Na+)>c(Al3+)>c(H+)>c(OH—) |
下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
| A.1L0.1mol·L-1(NH4)2Fe(SO4)2溶液: c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| B.25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中: c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| C.25℃时,BaCO3饱和溶液(Ksp =8.1×10-9): c(Ba2+)= c(CO32-)>c(H+) = c(OH-) |
| D.1.0 mol·L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
下列关于电解质溶液说法正确的是 ( )
| A.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
| B.等体积的pH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB |
| C.常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA‾的电离程度大于其水解程度 |
| D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
下列说法正确的是
| A.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 |
| B.已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01% |
| C.0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液等体积混合,则溶液中: 2c(H+) + c(CH3COOH) =" 2" c(OH-) + c(CH3COO-) |
| D.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变 |
下列说法中正确的是
A.若M度T0C时水的离子积常数为KW在该温度下的中性溶液中c(H+)=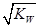 mol/L mol/L |
| B.25℃时HCl溶液中的c(H+)一定大于25℃时NH4Cl溶液中的c(H+) |
| C.1mol/LCH3COOH溶液和1mol • L-1KOH溶液等体积混合,混合溶液中c(K+)=c(CH3COO-) |
| D.pH =5.7的 NaHSO3溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
有关电解质溶液的叙述错误的是( )
A.向氨水中加水可使溶液中n(OH-)增大
B.若Na2A、Na2B溶液的pH分别为8和9,则酸性一定是H2A>H2B
C.常温下,pH=2的某二元强酸和pH=12的某一元强碱溶液等体积混合,所得溶液的pH一定等于7
D.0.5 mol/L的醋酸钠溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是
| A.Na2SO3溶液中存在:c(Na+)>c(SO32-)>c(H2SO3)>c(HSO3-) |
| B.已知NaHSO3溶液pH<7,该溶液中:c(Na+)>c(HSO3-)>c(H2SO3) >c(SO32-) |
| C.当吸收液呈中性时:c(Na+)=2 c(SO32-)+c(HSO3-) |
| D.当吸收液呈酸性时:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
下列各溶液中,微粒的物质的量浓度关系表述正确的是
| A.常温下pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 |
| B.0.lmol/LNa2CO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C.0.2mol/LNaA溶液和0.lmol/L盐酸溶液等体积混合所得碱性溶液中: c(Na+)+c(H+)=c(A—)+c(Cl—) |
| D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 |
试题篮
()