下列溶液中有关物质的量浓度关系不正确的是
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH) < c(NaHCO3) <c(CH3COONa)
B.已知25℃时Ksp (AgCl)=1.8×10-10,则在0.3mol·L-1NaCl溶液中,Ag+的物质的量浓度最大可达到6. 0×10-10mol·L-1
C.25℃时,0.1mol·L-1Na2CO3溶液中水电离出来的c(OH-)大于0.1mol·L-1NaOH溶液中水电离出来的c(OH-)
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有c(HA-) >c(H+)>c(H2A)>c(A2-)
从下列事实所得出的结论或给出的解释正确的是
| |
实验事实 |
结论或解释 |
| A |
将40 g NaOH溶于1 L蒸馏水中 |
该溶液的物质的量浓度为1mol﹒L-1 |
| B |
0.1 mol/L CH3COOH溶液在稀释过程中 |
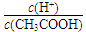 将变小 将变小 |
| C |
酸H2X为弱酸 |
常温下,盐NaHX溶液pH一定大于7 |
| D |
在溶液的稀释过程中 |
离子浓度:有的可能增大,有的可能减小,有的可能不变 |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4] –(aq)+H+(aq)。 下列说法一定正确的是
[B(OH)4] –(aq)+H+(aq)。 下列说法一定正确的是
| 化学式 |
电离常数(298K) |
| 硼酸 |
K=5.7×10-10 |
| 碳酸 |
Ki1=4.4×10-7 Ki2=4.7×10-11 |
| 醋酸 |
K=1.75×10-5 |
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.醋酸滴入碳酸钠溶液中能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较, pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
下列图示与对应的叙述相符的是 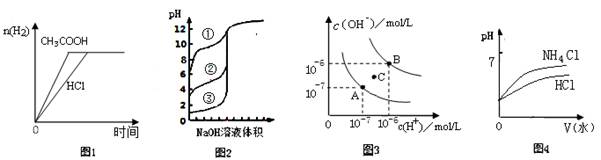
| A.图1中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化 |
| B.图2表示用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强 |
| C.图3为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
| D.图4表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者 pH的变化 |
下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。 若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
下列电解质溶液的有关叙述正确的是
| A.在含有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)增大 |
| B.在NH4Cl溶液中加入适量盐酸,可使c(NH4+)=c(Cl-) |
C.含l mol KOH的溶液与l mol CO2完全反应后,溶液中c(K+)>c(HCO )>c(OH-)>c(H+)>c(CO32-) )>c(OH-)>c(H+)>c(CO32-) |
| D.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
下列叙述正确的是
| A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵 |
| B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 |
| C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变 |
| D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
在密闭容器中进行X2(g)+4Y2(g) 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是
| A.c(X2)="0.15" mol·L-1 | B.c(Y2)="0.9" mol·L-1 |
| C.c(Z2)="0.3" mol·L-1 | D.c(Q2)="0.5" mol·L-1 |
含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为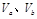 ,则两者的关系正确的是
,则两者的关系正确的是
A.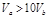 |
B.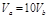 |
C.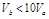 |
D.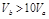 |
有100 mL 3 mol·L-1的氢氧化钠溶液和100 mL 1 mol·L-1的氯化铝溶液。按如下两种方法进行实验:
①将氢氧化钠溶液分多次加入到氯化铝溶液中;
②将氯化铝溶液分多次加入到氢氧化钠溶液中。
比较两次实验,结果是( )
| A.现象相同,最终沉淀量相等 | B.现象不同,最终沉淀量不相等 |
| C.现象相同,最终沉淀量不相等 | D.现象不同,最终沉淀量相等 |
在a、b两支试管中,分别装入足量Na2CO3粉末,然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白。
(1)a、b两支试管中的现象:相同点是__________,不同点是__________________。原因是__________________。
(2)a、b两支试管中生成气体的速率开始时是a__________b,反应完毕后生成气体的总体积是a__________b,原因是__________________。
下列叙述正确的是
| A.可用于电动汽车的铝-空气燃料电池,通常用NaOH溶液做电解液,其正极反应为:O2+2H2O+4e-===4OH- |
| B.常温下,PH均为5的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度均为1×10-9 mol·L-1 |
| C.溴化钠溶液中加入少量新制氯水充分反应后,再加入少量苯振荡静置后上层颜色变浅,下层颜色变为橙红色 |
| D.导电、缓慢氧化、品红褪色和久置浓硝酸变黄都一定属于化学变化 |
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=________。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是____________________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol·L-1 |
| B.若V1=V2,反应后溶液的pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
试题篮
()