某二元酸(化学式用H2A)表示,在水中的电离方程式是:
H2A = H+ + HA-, HA-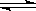 H+ + A2- 回答下列问题:
H+ + A2- 回答下列问题:
(1)Na2A溶液呈 (填”酸性,中性或碱性”),理由是,用离子方程式表示:
.
(2)若0.1 mol•L-1NaHA溶液的pH = 2,则0.1 mol•L-1H2A溶液中氢离子的物质的量浓度可能是___________0.11 mol•L-1(填>、<、=)。理由是_________________________
(3)0.1 mol•L-1NaHA溶液中各种离子浓度由大到小的顺序是______________________
25℃,在20 mL 0.1mol/L 氨水溶液中逐滴加入0.2mol/L HCl溶液(如图),下列说法正确的是
A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
B.在C点,c<10,且有c(NH4+)=c(Cl—)=c(OH-)=c(H+)
C.若25℃ 0.1mol/L 氨水电离度为1.33%,则b<a<12
D.在D点:2c(NH4+)+2c(NH3·H2O)=c(Cl—)
现有常温下的四份溶液:①pH=2的CH3COOH溶液;②pH=2的稀HCl;③0.01mol/L氨水;
④0.01mol/L NaOH溶液。下列说法正确的是
| A.将四份溶液稀释相同倍数后,溶液的pH:③<④,②<① |
| B.若将②、③等体积混合,则混合液的PH为7 |
| C.四份溶液中水的电离程度由大到小的顺序为:③>①=②=④ |
| D.若在10mL①中加入④至PH刚好等于7,则C(Na+)= C(CHCOO-),混合溶液总体积< 20mL(假设混和溶液体积为酸和碱溶液体积之和) |
常温下,有四种溶液:
| ① |
② |
③ |
④ |
⑤ |
| 0.001mol·L-1 CH3COOH溶液 |
pH=10 NaOH溶液 |
0.001mol·L-1 NaOH溶液 |
pH=4 CH3COOH溶液 |
pH=4 NH4Cl溶液 |
回答下列问题:
(1)①稀释到原来的10倍后的溶液pH ④溶液的pH。 (填“>”或“=”或“<”等,下同)。
(2)④和⑤两溶液中水电离出的c(H+):④ ⑤。
(3)①与③混合,若溶液pH=7,则两溶液体积关系为V(NaOH) ______V(CH3COOH)。
(4)②与④等体积混合,则溶液pH 7,其所得溶液中的溶质组成可能为: 。
下列叙述正确的是( )
| A.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| B.c(H+)=c(OH-)=1×10-6mol/L溶液一定呈中性 |
C.pH=5的H2SO4的溶液稀释500倍以后,溶液中的c(H+):c(SO )=2:1 )=2:1 |
| D.0.1 mol·L-1 CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
下列变化规律不正确的是 ( )
| A.温度升高,水的电离平衡向右移动 |
| B.加水稀释时,醋酸钠的水解平衡向左移动 |
| C.增大压强,对醋酸的电离平衡影响不大 |
| D.向氯化铁溶液中加入氧化钠,水解平衡向右移动 |
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题: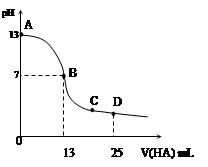
(1)写出MOH在水溶液中的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)写出B点混合溶液中各离子浓度的大小关系_________ _;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L(数字表达式,不必具体算出结果)
(1)某温度下,纯水中c [H+]=2.0×10-7 mol/L,则此时c [OH-] = mol/L,水的离子积Kw= ;相同条件下,测得① Na2CO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
(2)pH值相同的 HCl(aq)、H2SO4(aq)、 CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 ;
②分别用0.1 mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是 。
③反应开始时,反应速率 。(从下面选项中选择填写)
| A.HCl最快; | B.H2SO4最快; | C.CH3COOH最快; | D.一样快 |
(3)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+) > c( CN-),用“>、<、=”符号填空
①溶液中c (OH-) c (H+) ②c (HCN) c (CN-)
(4)①Na2CO3溶液的pH 7(填“>、<、=”),
其原因是 (用离子方程式表示)
②若溶液Na2CO3溶液和Al2(SO4)3溶液混合,观察到有白色絮状沉淀和无色气体生成,该反应的离子方程式为
(5)下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数(mol2·L-2) |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
①若25<t1<t2,则a__________1×10-14 mol2·L-2(填“>”、“<”或“=”),做此判断的理由是________________________。
②25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________。
③t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的顺序是_______ _____。
对于可逆反应M+N Q 达到限度的标志是( )
Q 达到限度的标志是( )
| A.M、N、Q三种物质的浓度一定相等 | B.M、N全部变成了Q |
| C.M、N、Q三种物质的浓度不再变化 | D.反应已经停止 |
常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如右下图所示(不考虑挥发)。下列说法正确的是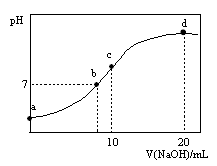
A.点a所示溶液中:c(NH )>c(SO )>c(SO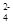 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
B.点b所示溶液中:c(NH )=c(Na+)>c(H+)=c(OH-) )=c(Na+)>c(H+)=c(OH-) |
C.点c所示溶液中:c(SO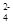 )+ c(H+)= c(NH3·H2O )+ c(OH-) )+ c(H+)= c(NH3·H2O )+ c(OH-) |
D.点d所示溶液中:c(SO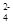 )>c(NH3·H2O )>c(OH-)>c(NH )>c(NH3·H2O )>c(OH-)>c(NH ) ) |
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定量的HA的配制0.1mol/L的溶液100mL;②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都用到的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填“>”、“<”、“=”)。
乙方案中,说明HA是弱电解质的现象是 (填字母序号,多选倒扣分)。
a.装HCl的试管中放出H2的速率快;
b.装HA溶液的试管中入出H2的速率快;
c.两个试管中产生气体速率一样快。
(3)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
。
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.1L 1mol/L醋酸溶液中含有的离子总数为2NA |
| B.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
| C.100mL 1mol∙L-1的Na2CO3溶液中CO32-、HCO3-和H2CO3总数为0.1NA |
| D.0.1L 3mol·L-1的FeCl3溶液中含有的Fe3+数目为0.3 NA |
分已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:__________________。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.8×10-13,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=______________(保留三位有效数字)mol/L。
某盐酸的密度为1.095g·cm-3,质量分数为10.0%,试计算:
(1)该盐酸的物质的量浓度是多少?
(2)200mL该盐酸跟足量的锌粒充分反应,生成气体的体积(标准状况下)是多少L?
研究化学反应原理对于生产、生活及环境保护具有重要意义。
(1)工业制硫酸的过程中存在反应: 。
。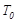 ℃时,将2mol
℃时,将2mol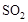 和1.5 mol
和1.5 mol 充入2L密闭容器中发生上述反应,容器中
充入2L密闭容器中发生上述反应,容器中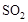 的物质的量随温度变化的曲线如图所示。
的物质的量随温度变化的曲线如图所示。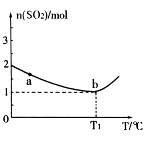
①图中a点的正反应速率 (填写“>”“<”或
“=”)逆反应速率。
②下列条件可以证明上述反应已经达到化学平衡状态的是 (填写序号)
a.单位时间内消耗1mol ,同时生成2mol
,同时生成2mol
b.容器内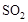 、
、 、
、 的浓度之比为2∶1∶2
的浓度之比为2∶1∶2
c.容器内压强保持不变
d.混合气体的平均相对分子质量保持不变
③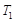 ℃时,上述反应的化学平衡常数K= 。
℃时,上述反应的化学平衡常数K= 。
(2)碳酸铵是一种常用的铵态氮肥,其水溶液显碱性,其原因是 ;溶液中离子浓度关系为 。
。
(3)治理水体重金属离子污染时,首先投入沉淀剂将重金属离子转化为难溶悬浮物,然后再投入氯化铝将污水中的悬浮物除去,从而净化水体,氯化铝的作用是
(用离子方程式表示)。
试题篮
()