可逆反应mA(g) nB(g)+pC(s);△H="Q," 温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图像,以下叙述正确的是
nB(g)+pC(s);△H="Q," 温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图像,以下叙述正确的是
| A.m>n, Q<0 | B.m>n+p,Q>0 |
| C.m>n, Q>0 | D.m<n+p, Q <0 |
对于可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ,下列叙述正确的是
4NO(g)+6H2O(g) ,下列叙述正确的是
| A.达到化学平衡状态时,4v正(O2)=5V逆(NO) |
| B.化学反应速率的关系为2V正(NH3)=3V正(H2O) |
| C.达到化学平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到化学平衡状态 |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr(g)
2HBr(g) 平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
| A.a>b | B.a=b | C.a<b | D.无法确定 |
下列能用勒夏特列原理解释的是
A.溴水中存在下列平衡Br2+H2O HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅 HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅 |
| B.工业上由氢气和氮气合成氨是在较高温度下进行的 |
| C.SO2催化氧化成SO3的反应,需要使用催化剂 |
| D.H2、I2、HI平衡混和气加压后颜色变深 |
有温度和容积均相同的两容器Ⅰ、Ⅱ,向Ⅰ中加入1 mol NO 2 ,Ⅱ中加入2 mol NO 2 ,都将发生反应2 NO 2 (g) N 2 O 4 (g),反应达到平衡时,测得Ⅰ中NO 2 的转化率为a%,Ⅱ中NO 2 的转化率为b%,则a、b的关系为
N 2 O 4 (g),反应达到平衡时,测得Ⅰ中NO 2 的转化率为a%,Ⅱ中NO 2 的转化率为b%,则a、b的关系为
| A.a<b | B.a>b | C.a=b | D.无法确定 |
乙苯催化脱氢制苯乙烯反应:

(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=____________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________ (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和 水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实______________。
②控制反应温度为600℃的理由是 ____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有__________(填编号)。
① CO2与H2反应,使乙苯脱氢反应的化学平 衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
对可逆反应2A(s)+3B(g)  C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v(正)减小③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度,v(正)>v(逆) ⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
在一定温度下,将气体X和气体Y各0. 16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)  2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.0~2 min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡时v(正)< v(逆)
C.该温度下此反应的平衡常数K=144
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5L |
0.5L |
1. 0L |
| 温度/℃ |
T1 |
T2 |
T2 |
| 反应物 起始量 |
1.5molA 0.5 molB |
1.5 molA 0.5 molB |
6.0 molA 2.0 molB |

下列说法正确的是
A.l0min内甲容器中反应的平均速率v(A)=0.025mol·(L·min)-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是

| A.①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0 |
| B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像 |
| C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线 |
| D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2 |
2SO2(g)+O2(g) 2SO3(g) △H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是
2SO3(g) △H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是
| A.甲和乙中反应的化学平衡常数相同 |
| B.乙和丙中的二氧化硫的生成速率相同 |
| C.乙中SO2的体积分数大于丙 |
| D.转化率:α甲(SO2)+α乙(SO3)<1 |
下列事实能用勒沙特列原理解释的是
①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
②实验室中用氯化钠固体与浓硫酸共热制取氯化氢气体
③用排饱和食盐水法收集Cl2
④温度控制在500℃有利于合成氨反应
⑤工业制取金属钾Na(l)+ KCl(l)  NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
| A.②③⑤ | B.①③⑤ | C.②③④⑤ | D.①②③⑤ |
2NH3(g)+CO2(g) 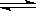 CO (NH2)2(s)+H2O(g) 在该可逆反应中,当化学平衡逆向移动时,体系气体的平均分子量会
CO (NH2)2(s)+H2O(g) 在该可逆反应中,当化学平衡逆向移动时,体系气体的平均分子量会
| A.不确定 | B.变小 | C.不变 | D.变大 |
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
试题篮
()