在一个固定体积为2升的密闭容器中,充入2molA和1molB,发生如下反应: 2A(g)+B(g)  3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
①2分钟内用B表示的平均反应速度为 ;
②若容器温度升高,平衡时混合气体的平均摩尔质量减小,则正反应为 (填 “吸热”或“放热”)反应。
一定温度下,1molX和nmolY在体积为2L的密闭容器中发生如下反应:X(g)+Y(g) 2Z(g)+M(s),5min后达到平衡,此时生成2amolZ。下列说法正确的是
2Z(g)+M(s),5min后达到平衡,此时生成2amolZ。下列说法正确的是
| A.用X表示此反应的反应速率是(0.1-0.2a)mol·(L·min)-1 |
| B.当混合气体的质量不再发生变化时,说明反应达到平衡状态 |
| C.向平衡后的体系中加入1molM,平衡向逆反应方向移动 |
| D.向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动 |
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K= 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
下列判断不正确的是
A.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
B.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
C.平衡时,乙中CO2的转化率大于60%
D.平衡时,甲中和丙中H2的转化率均是60%
温度一定时,在密闭容器中发生可逆反应:mA(S)+nB(g) pC(g),达到平衡后,若将混合气体的体积压缩到原来的
pC(g),达到平衡后,若将混合气体的体积压缩到原来的 ,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中,正确的是
,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中,正确的是
| A.平衡向逆反应方向移动 |
| B.C气体的体积分数增大 |
| C.气体A的转化率升高 |
| D.m+n<p |
对于可逆反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,下列叙述正确的是
2SO3(g) ΔH<0,下列叙述正确的是
| A.单位时间内生成2molSO3的同时消耗了1molO2,则反应到达平衡状态 |
| B.升高温度反应速率增大,由于该反应是放热反应,V(逆)小于V(正),所以反应达到平衡的时间将延长 |
| C.保持温度和密闭体系体积不变,起始加入2molSO2和1molO2,平衡后加入2molSO2和1molO2,重到达平衡时SO2的体积分数减小 |
D.该反应的化学平衡常数表达式为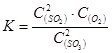 |
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成nmolCO的同时生成nmolH2 |
| D.1molH—H键断裂的同时断裂2molH—O键 |
(1)某可逆反应在不同条件下的反应历程分别为 、
、 ,如图所示。
,如图所示。

①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中 历程表明此反应采用的条件为 (选填序号)。
历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(2)1000℃时,硫酸钠与氢气发生下列反应:

该反应的平衡常数表达式为 。
已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)
(3)生铁在潮湿空气中会发生吸氧腐蚀。
①电解质溶液可选用(填序号) 。
A.NaOH溶液 B.C2H5OH C.NaCl溶液 D.稀硫酸
②写出生铁在潮湿空气中吸氧腐蚀正极的电极反应式 。
(1)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛地开发和应用前景。反应: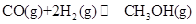
① 下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1__________0(选填“>”“=”或“<”),根据该反应特点,此反应自发进行的条件是____________(选填“高温”“低温”或“任何温度”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为___________。
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度见下表。
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/mol·L-1 |
0.2 |
0.1 |
0.4 |
①比较此时正、逆反应速率的大小:v正__________v逆(选填“>”“<”或“=”)
②若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4mol·L-1,则该时间内反应速率v(CH3OH)=_____________。
(3)已知: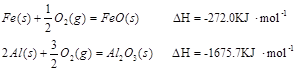
Al和FeO发生铝热反应的热化学方程式是 。
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10-38;当溶液的pH=4时, 则此溶液中Fe3+的物质的量浓度是_____________。
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达平衡后,再通入一定量N2O5,则N2O5的转化率将_______。(填““增大”“减小”或“不变”);
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1 000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为_________________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2___________T1。
(2)下图所示装置可用于制备N2O5,则N2O5在电解池的_________区生成,其电极反应式为_________________。
Ⅰ 恒温、恒压下,在一个可变容积的容器中发生如下反应: A(气)+B(气) C(气)。
C(气)。
(1)若开始时放入1 mol A和1 mol B,到达平衡后,生成a mol C,这时A的物质的量为 mol,
(2)若开始时放入3 mol A和3 mol B,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x mol A、2 mol B和1 mol C,到达平衡后,A和C的物质的量分别是y mol和3a mol,则x= mol,y= mol。平衡时,B的物质的量 (选填一个编号)。
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2 mol
Ⅱ 若维持温度不变,在一个与(Ⅰ)反应前起始体积相同、且容积固定的容器中发生上述反应。
(4)开始加入1 mol A和1mol B 时A的转化率为m,若开始时加入1 mol A和2 mol B 时A的转化率为n,则m n(“>”、“<”、“=”)
(5)开始时放入1 mol A和1 mol B到达平衡后生成b mol C。将b与(1)小题中的a进行比较____(选填一个编号)。
(甲)a<b (乙)a>b (丙)a="b" (丁)不能比较a和b的大小
氯气在298K、100kPa时,在1L水中溶解0.09mol即达饱和,实验测得溶于水的Cl2有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为_____ _____; 计算上述体系的平衡常数_____ 。
(2)若在该饱和氯水中①加入少量NaOH固体,平衡将向________移动,溶液的pH值将 (“增大”、 “减小”、“不变”);②通入适量氯气平衡将________移动。(填“向左”、“向右”、“不移动”)
(3)如果增大氯气的压强,平衡将向_________移动(填“左”、“右”)。氯气在水中的溶解度将______。(填“增大”、“减小”或“不变”),参与反应的氯气与溶解氯气的比值将______1/3(填“大于”、“小于”或“等于”)。
向恒容密闭容器中充入2.0 mol A和3.0 mol B,发生反应xA(g)+2B(g)  yC(g)。恒温下反应10 min后突然改变某一条件,12 min时达到化学平衡状态I;18 min时升高温度,22 min时达到化学平衡状态II。容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:
yC(g)。恒温下反应10 min后突然改变某一条件,12 min时达到化学平衡状态I;18 min时升高温度,22 min时达到化学平衡状态II。容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:
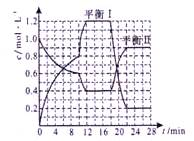
(1)从反应开始到10 min时,该反应的平均速率v(A)= ;平衡状态I时,反应物A的转化率a(A)=__________。x:y=__________。
(2)容器内的压强:平衡状态I与起始状态相比较是__________(选填“增大”、“减小”、 “相等”或“无法判断”),逆反应为___________反应(选填“放热”或“吸热”)。
(3)推测第10 min时改变的反应条件可能是___________(选填编号)。
①减压 ②降温 ③升温 ④加催化剂 ⑤增加B的量 ⑥充入氦气
(4)若已知平衡状态I时B的物质的量为0.6 mol,平衡状态I和平衡状态Ⅱ时该反应的平衡常数分别为K1和K2。则Kl=_ ,且K1__________K2(选填“>”、“<”或“=”)。
CO和NO都是常见的不成盐氧化物。回答下列问题:
(1)工业土用一氧化碳制取氢气的反应为:CO(g) + H2O(g) CO2(g) + H2(g),
已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
恒温恒容条件下,以下能说明该反应达到平衡状态的是 (填字母序号)。
a.V消耗(CO) = V生成(H2O)
b. c(CO2)=c(CO)
c. 混合气体的总物质的量不再改变
d. 混合气体的密度不再改变
(2)①汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:

写出该反应的热化学方程式: _ 。
②通过NOx传感器可监测NOx的含量,其工作原理如图,写出NiO电极的电极反应式: 。
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述正确的是:
| A.K值不变,平衡不可能移动 |
| B.平衡向右移动时,K值一定增大 |
| C.K值有变化,平衡一定移动 |
| D.相同条件下,同一个反应,其方程式的计量数增大2倍,K值也增大两倍 |
试题篮
()