下列事实中,不能用勒夏特列原理解释的是
| A.冰镇的啤酒打开后泛起泡沫 |
B.对N2+3H2 2NH3的反应,使用铁触媒可加快合成氨反应的速率 2NH3的反应,使用铁触媒可加快合成氨反应的速率 |
C.工业制取金属钾Na(l)+KCl(l)  NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 |
D.氯水中存在如下平衡:Cl2+H2O HCl+HClO,当加入NaOH溶液后颜色变浅 HCl+HClO,当加入NaOH溶液后颜色变浅 |
制取水煤气的反应为C(s)+H2O(g) 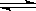 CO(g)+H2(g) △H > 0,欲提高反应的速率和C(s)的转化率,可采用的措施为
CO(g)+H2(g) △H > 0,欲提高反应的速率和C(s)的转化率,可采用的措施为
| A.降温 | B.增大水蒸气的浓度 | C.增大C(s)的量 | D.增大压强 |
1000K时,反应C(s)+2H2(g)  CH4(g)的 K=8.28×107,当各气体物质的量浓度分别为H2 0.7 mol·L-1、CH4 0.2 mol·L-1时,上述平衡
CH4(g)的 K=8.28×107,当各气体物质的量浓度分别为H2 0.7 mol·L-1、CH4 0.2 mol·L-1时,上述平衡
| A.向正反应方向移动 | B.向逆反应方向移动 |
| C.达到平衡 | D.无法判断移动方向 |
(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出热量649.5 中kJ,其热化学方程为 。
又已知:H2O(l)=H2O(g);ΔH=+44.0kJ/mol。则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量为 。
恒温、恒压(1.01×105Pa)下,将2.0molSO2与amolO2的混合气体通入一个容积可变的密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g);ΔH<0
2SO3(g);ΔH<0
(2)T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,则a=__________;平衡时SO2的转化率为_________。T2℃下反应达平衡时,混合气体的物质的量共为4.8mol.T1与T2的关系是________(选填序号)。
①T1>T2 ②T1<T2 ③T1=T2
可逆反应A(g)+3B(g) 2C(g);ΔH=-Q kJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1 kJ在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是
2C(g);ΔH=-Q kJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1 kJ在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是
A.甲中A的转化率为75%
B.Q1+Q2=Q
C.达到平衡后,再向乙中加入0.25 molA、0.75molB 、1.5molC,平衡向正反应方向移动
D.乙中的热化学反应方程式为2C(g) aA(g)+3B(g);ΔH=+Q2kJ·mol-1
aA(g)+3B(g);ΔH=+Q2kJ·mol-1
已知可逆反应 中,A、C的含量随温度的变化曲线如图所示,下列说法正确的是
中,A、C的含量随温度的变化曲线如图所示,下列说法正确的是
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到过化学平衡
C.该反应的正反应是吸热反应
D.升高温度,平衡会向正反应方向移动
将4molA和2molB在2L密闭容器中混合发生反应,2A(g)+B(g) 2C(g);ΔH<0,4秒后反应达到平衡状态,此时得C的浓度为0.6mol/L,下列说法正确的是
2C(g);ΔH<0,4秒后反应达到平衡状态,此时得C的浓度为0.6mol/L,下列说法正确的是
A.当A、B、C物质的量浓度化为2︰1︰2时,反应即达到平衡状态
B.4S内用物质B表示的反应速率为0.075mol/(L·S)
C.达平衡后通入一定量的氦气,A的转化率降低
D.达平衡后升高温度,C的浓度将增大
在一个不传热的固定容积的密闭容器中可逆反应mA(g)+nB(g) pC(g)+qQ(g) 当m、n、p、q为任意整数时,达到平衡的标志是
pC(g)+qQ(g) 当m、n、p、q为任意整数时,达到平衡的标志是
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D) =m:n:p:q
⑥单位时间内m mol A断键反应,同时pmol C也断键反应
A.③④⑤⑥ B.②③④⑥ C.①③④⑤ D. ①③④⑥
已知Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH=a kJ/mol,平衡常数为K;测得在不同温度下,K值如下:
FeO(s)+CO(g) ΔH=a kJ/mol,平衡常数为K;测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)该反应的平衡常数表达式K=______________________
(2)方程式中的a________0(填“大于”“小于”或“等于”)。
(3)700℃上述反应达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有__ ______(填序号)
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
一定温度下,反应N2(g)+3H2(g) 2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g)
2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g) 2N2(g)+6H2(g)的反应热和化学平衡常数为
2N2(g)+6H2(g)的反应热和化学平衡常数为
| A.2△H和2K | B.-2△H和 K2 |
| C.2△H和-2K | D.-2△H和 K-2 |
在密闭容器中,反应2X(g)+ Y2(g) 2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是
2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是
| A.图I中,甲、乙的平衡常数分别为K1、K2,则K1=K2 |
| B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低 |
| C.图Ⅱ中,t时间是增大了压强 |
| D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明甲温度高于乙 |
某密闭容器中发生如下反应:X(g)+Y(g) 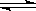 2Z(g) ΔH<0。如右图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g) ΔH<0。如右图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是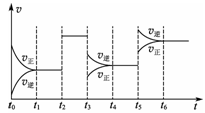
| A.t2时一定加入了催化剂 | B.t3时减小了压强 |
| C.t5时一定升高了温度 | D.t4~t5时间内转化率最低 |
一定条件下,对于可逆反应X(g)+3Y(g)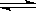 2Z(g),若X、Y、Z的起始浓度分别为c
2Z(g),若X、Y、Z的起始浓度分别为c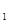 、c
、c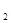 、c
、c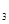 (均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判 断正确的是
(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判 断正确的是
A.c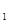 :c :c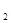 =1:2 =1:2 |
| B.平衡时,Y和Z的生成速率之比为2:3 |
| C.X、Y的转化率不相等 |
D.c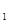 的取值范围为0<c 的取值范围为0<c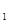 <0.14 mol/L <0.14 mol/L |
证明可逆反应N2+3H2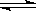 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N断裂的同时,有3个H-H键断裂;
②一个N≡N键断裂的同时,有6个N-H键断裂;
③其他条件不变时,混合气体平均相对分子质量不再改变;
④保持其他条件不变时,体系压强不再改变;
⑤NH3%、N2%、H2%都不再改变;
⑥恒温恒容时,密度保持不变;
⑦正反应速率v(H2)=0.6mol/,逆反应速率v(NH3)=0.4mol/
| A.②③④⑤⑦ | B.③④⑤⑥⑦ | C.②③④⑤⑥⑦ | D.全部 |
试题篮
()