某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
(1)可以判断该分解反应已经达到化学平衡的是___________。
A.
B.密闭容器中总压强不变
C.密闭容器中混合气体的平均相对分子质量不变
D.密闭容器中气体密度不变
(2)根据表中数据,列式计算15.0℃时的分解平衡常数:__________________________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。
(4)氨基甲酸铵分解反应的焓变△H____0,熵变△S___0(填>、<或=)。
在一定温度下将2 mol A和2 mol B两种气体混合于某2L密闭容器中,发生如下反应:3A(g)+B(g)  2C(g)+2D(g),2 min末反应达到
2C(g)+2D(g),2 min末反应达到 平衡状态,生成了0.8 mol D,请填写下列空白:
平衡状态,生成了0.8 mol D,请填写下列空白:
(1)2min内B的反应速率为_________________
(2)此温度下该反应的平衡常数K=_________________________
(3)如果缩小反应容器的体积,使压强增大,平衡体系中C的物质的量浓度_____________,C的质量分数___________,容器内气体的平均密度________________,平均相对分子质量________________。(填“增大”、“减小”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的物质的量与原平衡相等,则还应加入__________物质___________mol。
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g)  2SO3(g) △H=―190 kJ·mol—1
2SO3(g) △H=―190 kJ·mol—1
⑴该反应500℃时的平衡常数________450℃时的平衡常数(填“>”、“<”或“=”)。
⑵判断该反应达到平衡状态的标志是_______________。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.v(O2)正=2v(SO3)逆
e.容器中混合气体的密度保持不变
⑶欲提高SO2的转化率,下列措施可行的是_______________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
⑷在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol;若继续通入0.20 mol SO2和0.10 mol O2,则平衡_________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(SO3)<______mol。
氨氧化法制硝酸的主要反应是:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g)
4NO(g) + 6H2O(g)
⑴①该反应的熵变△S 0(填“>”、“<”或“=”)。
②升高温度,反应的平衡常数K值减小,则该反应的焓变△H 0(填“>”、“<”或“=”)。
⑵若其他条件不变,下列关系图错误的是 (选填序号)。
⑶在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
| 时间/浓度/(mol·L-1) |
c(NH3) |
c(O2) |
c(NO) |
c(H2O) |
| 起始 |
4.0 |
5.5 |
0 |
0 |
| 第 2 min |
3.2 |
|
0.8 |
1.2 |
| 第 4 min |
2.0 |
3.0 |
2.0 |
3.0 |
| 第 6 min |
2.0 |
3.0 |
2.0 |
3.0 |
①反应在第 2 min 到第 4 min 时,反应速率υ(O2) = ;
②反应在第 2 min 时改变了条件,改变的条件可能是 。
该条件下,反应的平衡常数K= (只写计算结果,不标单位)。
.向一定体积的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质的量浓度随时间变化如图(Ⅰ)所示,其中t0--t1阶段c(B)未画出。图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化 的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、压强、温度、催化剂中的一个条件,其中t3---t4阶段为使用催化剂。
的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、压强、温度、催化剂中的一个条件,其中t3---t4阶段为使用催化剂。
请回答下列问题:
(1)若t1="15" min,则t0---t1阶段以C物质的浓度变化表示的反应速率为 mol·  L—1·min—1。
L—1·min—1。
(2)t4--t5阶段改变的条件为 ,B的起始物质的量浓度为 mol· L—1。
(3)t5----t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中的热效应为a kJ热量,写出此温度下该反应的热化学方程式


下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
I.已知该产业链中某反应的平衡表达式为:K= ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa, 温度230~280℃)进行下列反应:
温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中总反应的热化学方程式为 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是 ,其原因是 .
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示。写出a电极上发生的电极反应式  。
。
把N2和H2以1:1的物质的量比混合后分成四等份,分别同时充入A、B、C、D四个装有催化剂的真空容器中(四个容器的容积固定,且不等),在保持相同温度的条件下,四容器中的合成氨反应相继达到平衡状态。分析表中的实验数据后回答有关问题((2)(3)小题用A、B、C、D填空)。
| 容器代码 |
A |
B |
C |
D |
平衡时 (混) (混) |
|
|
16 |
17 |
| 平衡时N2转化率 |
20% |
① |
② |
③ |
| 平衡时H2转化率 |
|
30% |
|
|
(1)①②③分别为 、 、 。
(2)都达到平衡时, 容器的NH3的物质的量所占的比例最大。
(3)四个容器的容积由小到大的顺序是 。
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:
 混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: 
① 的△H 0(填“>”
的△H 0(填“>”
或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,
平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,
则K1 K2;反应进行到状 态D时,V正 v逆(填“>”、“<”或“=)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业
生产、生活中有着重要作用。
① 图是一定的温度和压强下是N2和H2反应生成1molNH3过
程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
。(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与
b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则
c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示该混合溶液中一水合出氨的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。已知:25 ℃时,KSP(AgCl)=1.6×10-10mol2·L-2、KSP(AgI)=1.5×10-16mol·L-2,在25℃下,向100mL 0.002mol·L-1的NaCl溶液中逐滴加入100mL 0.002mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
℃时,KSP(AgCl)=1.6×10-10mol2·L-2、KSP(AgI)=1.5×10-16mol·L-2,在25℃下,向100mL 0.002mol·L-1的NaCl溶液中逐滴加入100mL 0.002mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
⑴现有一透明的注射器针筒,充满NO2气体(如图甲),当推动活塞时,气体的颜色将 (填“变浅”、“变深”、“先变深后变浅”或“先变浅后变深”),当气体体积变为图甲的一半时(如图乙),NO2的浓度 (填“大于”、“等于”或“小于”)推压活塞前NO2浓度的2倍。当观察到 时,可确定针筒内已经达到了化学平衡状态。当活塞后拉时,通过针筒又吸进少量NO2气体, 再前推活塞固定在图乙位置,NO2的转化率将 (填“增大”、“减小”、或“不变”)。
再前推活塞固定在图乙位置,NO2的转化率将 (填“增大”、“减小”、或“不变”)。
⑵另有一透明的注射器针筒,充满H2、I2、HI气体(如图甲),当推动活塞时,气体的颜色将 (填“变浅”、“变深”、“先变深后变浅”或“先变浅后变深”),当气体体积变为图甲的一半时(如图乙,此时I2仍为气体),HI的浓度 (填“大于”、“等于”或“小于”)推压活塞前HI浓度的2倍。
450K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g) 2SO3(g);
2SO3(g);
△H=-96.56kJ/mol,△S=-190 J•mol-1•K-1。
甲容器在反应过程中保持压强不变,乙容器保
持体积不变,丙容器维持绝热,三容器各自建
立化学平衡。
(1)平衡常数:K (甲) K (乙) _ K(丙) (填“>”、“<”或“=”)。
(2)达到平衡时SO2的转化率:α(甲) _ α(乙) _ α(丙)(填“>”、“<”或“=”)。
(3)达到平衡后,若向甲、乙两容器中分别通入少量且等量Ar气体, 甲容器的化学平衡________移动,乙容器的化学平衡_________移动。(填“正向”、“逆向” 或“不”)
(4)通过计算确定5000C时正反应 ____ (填“能” 或“不能”)自发进行。
在一密闭体系中发生下列反应:N2(g)+3H2(g) 2NH3(g);△H<0 。
2NH3(g);△H<0 。
回答下列问题:
(1)在一定温度下,向一容积为2L的密闭容器中通入0.3molN2和0.9molH2,2min达到平衡时,C(N2)为0.1mol/L,则H2的转化率为____________________,用H2浓度变化表示的平均
反应速率为__ ____ ,该温度下的平衡常数K= ____________。
(2)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态(1)相同,则起始时n(NH3)的取值范围为 ___________________ 。
(3)右图是某一时间段速率-时间曲线图。
若图中t1时刻将容器体积变为原来的1/2倍,当t2时刻再次达到平衡时N2的浓度为原平衡的1.9倍,则平衡 _____
(“正移”“逆移”“不移动”)。
①请在图中画出t1→t2时间段反应速率变化情况。
②t3、t5时刻体系中所改变的某一条件分 别是:__________________________、_______________;其中表示平衡混合物中NH3的含量最高的时间段是___________.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
(2)全钒氧化还原液流电池,是目前发展势头强劲的优秀绿色环保储能电池。
其电池总反应为:
V3++VO2++H2O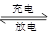 VO2++ 2H++V2+。
VO2++ 2H++V2+。
充电过程中,H+向 迁移(填“阴极区”或“阳极区”)。充电时阴极反应式为 。
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
该反应的化学平衡常数表达式为K= 。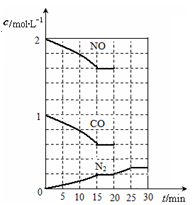
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如上图所示。若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、 “向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如上图所示的变化,则改变的条件
可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(16分)化学学科中的平衡理论主要内 容包括:化学平衡、电离平衡、水解平衡和
容包括:化学平衡、电离平衡、水解平衡和
溶解平衡等四种,且均符合勒夏特列原理。请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)  4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变
条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是 。
①增加C的物质的量②加压 ③升温④使用催化剂
(2)反应C(s)+CO (g)
(g)  2CO(g)平衡常数K的表达式为 ;
2CO(g)平衡常数K的表达式为 ;
已知C(s)+H 0(g)t
0(g)t CO(g)+H
CO(g)+H (g)的平衡常数为K1;H
(g)的平衡常数为K1;H (g)+CO
(g)+CO (g)
(g)  C0(g)
C0(g)
+H 0(g)的平衡常数为恐,则K
0(g)的平衡常数为恐,则K 与K
与K 、K
、K 二者的关系为 。
二者的关系为 。
(3)已知某温度下,反应2SO +0
+0
 2S0
2S0 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积
固定的密闭容器中,co(SO )=lmol·L
)=lmol·L c0(O
c0(O )=1mol·L
)=1mol·L ,当反应在该温度下SO
,当反应在该温度下SO 转化率
转化率
为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向
(填“正反应”或“逆反应”)方向进行。
(4)对于可逆反应:aA(g)+bB(g)  cC(g)+riD(g)△H=
cC(g)+riD(g)△H= kJ·mol
kJ·mol ;若
;若 +b>
+b>
c+d,增大压强平衡向 (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向
逆反应方向移动,则 0(填“>”或“<”)。
0(填“>”或“<”)。
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮
方法。已知:N2(g) + 3H2(g)  2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。
恒温下,往一个4L的密闭容器中充人2molN2和5.2molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/mol·L—1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
①5min内,消耗H2的平均反应速率为____________
②N2的平衡转化率
③计算此条件下该反应的化学平衡常数K=__________________________。
④若维持容器体积不变,只升高温度化学平衡常数值 (填变大、变小、不变),正反应速率 (填变大、变小、不变)。
⑤若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度 0.4
mol·L—1(填大于、小于、等于)
⑥若维持容器体积不变,充入He使之压强增大一倍,正反应速率 (填
变大、变小、不变),若维持压强不变,充入He,则平衡移动方向为 (填正移、逆移、不移)
(16分)(1)已知:
Fe(s)+1/2O2(g)=FeO(s) 
2Al(s)+3/2O2(g)= Al2O3(s) 
Al和FeO发生铝热反应的热化学方程式是_____________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如下图所示。
①据图判断该反应是_____(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__ _ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用了催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)  Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性____________
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为 。(填序号)
a..NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
试题篮
()