通过一个阶段的复习,你认为下列说法正确的是
| A.在氧化还原反应中,一种元素被氧化的同时一定有另一种元素被还原 |
| B.在原电池装置中,一定要有两个活泼性不同的金属电极 |
| C.在化合物中,不是电解质就是非电解质 |
| D.对于可逆反应,温度升高则该反应的平衡常数一定增大 |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是
| A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| D.用MgCl2·6H2O制取无水MgCl2时需在HCl气流中进行 |
对于达到平衡状态的可逆反应:N2+3H2 2NH3 (正反应为放热反应)下列叙述中正确的是
2NH3 (正反应为放热反应)下列叙述中正确的是
| A.反应物和生成物的浓度相等 |
| B.反应物和生成物的浓度不再发生变化 |
| C.降低温度,平衡混合物里氨气的浓度减小 |
| D.增大压强,不利于氨的合成 |
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
| A.加入一种反应物 | B.升高温度 |
| C.对平衡体系增加压强 | D.使用催化剂 |
对于密闭容器中进行的反应CO(g) + H2O(g)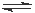 CO2 (g) +H2 (g),达到平衡后,其他条件不变,增大CO的浓度,下列说法不正确的是
CO2 (g) +H2 (g),达到平衡后,其他条件不变,增大CO的浓度,下列说法不正确的是
| A.正反应速率增大 |
| B.逆反应速率减小 |
| C.达到平衡时,逆反应速率比原平衡要大 |
| D.化学平衡常数不变 |
反应N2(g)+3H2(g) 2NH3(g) △H<0已达到平衡,只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
2NH3(g) △H<0已达到平衡,只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
| A.K值不变,平衡可能移动 | B.K值变化,平衡一定移动 |
| C.平衡移动,K值可能不变 | D.平衡移动,K值一定变化 |
下列有关颜色变化错误的是
| A.在4mL0.1mol/L的K2Cr2O7溶液中滴加数滴1mol/LNaOH溶液,溶液颜色从橙色变成黄色 |
| B.在试管中加入少量氯化钴晶体,滴加浓盐酸溶解后加水稀释至紫色,将试管置于热水中片刻,溶液颜色变成粉红色 |
| C.向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 |
| D.用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),从针筒顶端观察,气体颜色先变深后变浅 |
某温度下,可逆反应mA(g)+nB(g) pC(g)的平衡常数为K,下列对K的说法正确的是
pC(g)的平衡常数为K,下列对K的说法正确的是
| A.K值越大,表明该反应越有利于C的生成,反应物的转化率越大 |
| B.若缩小反应器的容积,能使平衡正向移动,则K增大 |
| C.温度越高,K一定越大 |
| D.如果m+n=p,则K=1 |
下列叙述中,不能用勒夏特列原理解释的是
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.加入催化剂有利于氨的合成 |
D.工业制取金属钾Na(l)+KCl(l) NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
某温度下,反应SO2(g)+ O2(g)
O2(g) SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g) 2SO2(g)+O2(g)的平衡常数K2的值为
2SO2(g)+O2(g)的平衡常数K2的值为
| A.2500 | B.100 | C.4×10-4 | D.2×10-2 |
下图中曲线表示一定条件下可逆反应X(g)+Y(g) 2Z(g)+W(s);ΔH<0的反应过程。若使a曲线变为b曲线,可采取的措施是
2Z(g)+W(s);ΔH<0的反应过程。若使a曲线变为b曲线,可采取的措施是
| A.加入催化剂 | B.增大Y的浓度 |
| C.降低温度 | D.增大体系压强 |
下列说法中不正确的是
| A.在相同条件下,反应可向正方向进行,又可向逆方向进行的反应就是可逆反应 |
| B.在其他条件不变时,升高温度可以使化学平衡向吸热反应的方向移动 |
| C.有气体的可逆反应,在其他条件不变时,增大压强可使化学平衡向气体体积缩小的方向移动 |
| D.在其他条件不变时,使用催化剂既可以加快化学反应速率,又可以使化学平衡状态移动 |
在一定条件下,反应2HI(g) H2(g)+ I2(g)(紫红色) ΔH>0,达到平衡时,要使混合气体的颜色加深,可采取的措施是
H2(g)+ I2(g)(紫红色) ΔH>0,达到平衡时,要使混合气体的颜色加深,可采取的措施是
①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强
| A.①③⑥ | B.②④⑤ | C.③⑤⑥ | D.①③⑤ |
试题篮
()