在恒容的密闭容器中,可逆反应X(s)+3Y(g) 2Z(g);△H>0,达到平衡时,下列说法正确的是
2Z(g);△H>0,达到平衡时,下列说法正确的是
| A.充入少量He使容器内压强增大,平衡向正反应方向移动 |
| B.升高温度,平衡向正反应方向移动,平均分子量变小 |
| C.继续加入少量X,X的转化率减小,Y的转化率增大 |
| D.继续加入少量Y,再次平衡时,Y的体积分数比上次平衡小 |
3molA和2.5molB混合于容积为2L的容器内,使它们发生反应2A(s)+3B(g) 2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
| A.B的平均消耗速率为0.3mol/(L·min) |
| B.C的平衡浓度为2mol/L |
| C.平衡后,增大压强,平衡将向正方向移动 |
| D.若反应容器内气体的密度不再发生变化,说明反应已经达到平衡 |
在一定条件下发生反应3A(g)+2B(g) zC(g)+2D(g),在2L的密闭容器中把4molA和2molB混合,2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)="0.2" mol·L–1 ·min–1。则下列说法不正确的是
zC(g)+2D(g),在2L的密闭容器中把4molA和2molB混合,2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)="0.2" mol·L–1 ·min–1。则下列说法不正确的是
A.z=4
B.B的转化率是40%
C.A的平衡浓度是1.4 mol·L–1
D.平衡时气体物质的量是原来的
在恒容密闭容器中,可以作为2NO2(g)  2NO(g)+O2(g) 达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
2NO(g)+O2(g) 达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
A ①③⑤⑦ B.②④⑤ C.①③④ D.①②③④⑤
右图是关于反应A2(g)+3B2(g) 2C(g)ΔH<0的平衡移动图像,影响平衡移动的原因是
2C(g)ΔH<0的平衡移动图像,影响平衡移动的原因是
| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时使用催化剂 |
| D.增大反应物浓度,同时减小生成物浓度 |
纳米钴(Co)加氢反应的催化剂,500K时催化反应:CO(g)+3H2(g )  CH4(g)+H2O(g) △H<0。有关说法正确的是
CH4(g)+H2O(g) △H<0。有关说法正确的是
| A.纳米技术的应用,提高了催化剂的催化性能,但平衡常数不变 |
| B.缩小容器体积,平衡向正反应方向移动CO的浓度减小 |
| C.温度越低,越有利于CO催化加氢 |
| D.从平衡体系中分H2O(g)能加快正反应速率 |
工业上常利用CO与SO2反应生成固态S单质和CO2,从而消除这两种气体对大气的污染:2CO(g)+SO2(g) 2CO2(g)+S(s)△H=﹣a kJ/mol(a>0),下列叙述正确的是
2CO2(g)+S(s)△H=﹣a kJ/mol(a>0),下列叙述正确的是
A.该反应的平衡常数表达式为K= |
| B.若反应开始时投入2 mol CO,则达平衡时,放出热量为a kJ |
| C.增大压强或升高温度都可以加快化学反应速率并提高SO2的转化率 |
| D.若单位时间内生成2 molCO2的同时,消耗1mol SO2,则说明反应达到平衡状态 |
已知:NO2(g)+SO2(g) SO3(g)+NO(g),现将体积之比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
SO3(g)+NO(g),现将体积之比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
| A.体系压强保持不变 |
| B.混合气体颜色保持不变 |
| C.SO3与NO的体积比保持不变 |
| D.每消耗1molSO2,同时生成1molNO |
对已达化学平衡的反应:2X(g)+Y(g) 2Z(g),减小压强后,对反应产生的影响是
2Z(g),减小压强后,对反应产生的影响是
| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正反应速率先减小后增大,逆反应速率减小,平衡向逆反应方向移动 |
| D.逆反应速率先减小后增大,正反应速率减小,平衡向逆反应方向移动 |
关于反应3A(g)+B(g) 2C(g)发生过程中的能量变化如图,下列说法中不正确的是
2C(g)发生过程中的能量变化如图,下列说法中不正确的是
| A.该反应为放热反应 |
| B.反应体系中加入催化剂,E1、E2减小,△H不变 |
| C.增大反应体系压强,化学平衡正向移动,气体B的浓度减少 |
| D.降低反应体系温度,反应速率减慢,A的转化率增大 |
已知2SO2(g) + O2(g) 2SO3(g)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
2SO3(g)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
| A.若升高温度,可以加快反应速率 |
| B.使用催化剂是为了加快反应速率 |
| C.在上述条件下,SO2不能完全转化为SO3 |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)  2C (g) 达到平衡状态标志的是
2C (g) 达到平衡状态标志的是
(1)C生成速率与C分解速率相等
(2)单位时间内生成amolA,同时生成3amolB
(3)A、B、C的浓度不再变化
(4)A、B、C的物质的量不再变化
(5)混合气体的总压不再变化
(6)混合气体的物质的量不再变化
(7)单位时间内消耗a molA,同时生成3a molB
(8)A、B、C的分子数之比为1:3:2
A.(2) (8) B.(1) (6) C.(2) (4) D.(3) (8)
反应:A(气)+3B(气) 2C(气); ΔH < 0 达平衡后,将气体混合物的温度降低,下列叙述中正确的是
2C(气); ΔH < 0 达平衡后,将气体混合物的温度降低,下列叙述中正确的是
| A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动 |
| B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 |
| C.正反应速率和逆反应速率都变小,平衡向正反应方向移动 |
| D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动 |
下列说法正确的是
A.用右图所示方法可保护钢闸门不被腐蚀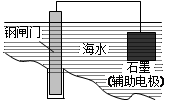 |
| B.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 |
C.常温下,NH4Cl溶液加水稀释,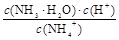 增大 增大 |
D.C(s)+H2O(g) CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
一定条件下,反应:C(s)+CO2(g) 2CO(g),ΔH>0在2L恒容密闭容器中进行,反应进行20s时,CO的物质的量增加了0.40 mol,则下列说法正确的是
2CO(g),ΔH>0在2L恒容密闭容器中进行,反应进行20s时,CO的物质的量增加了0.40 mol,则下列说法正确的是
A.反应20s,C的平均反应速率v (C) ="0." 005 mol·L-1·s-1
B.反应平衡时,v (CO2): v (CO) =1:2
C.升高温度时,正反应速率增大,逆反应速率减小
D.充入N2使体系压强增大,能提高反应速率
试题篮
()