反应N2O4(g) 2NO2(g) △H=+57kJ/mol,在温度T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) △H=+57kJ/mol,在温度T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a浅,c深 |
| C.a、b两点气体的平均相对分子质量:a>b |
| D.b、c两点化学平衡常数:b<c |
已知反应X(g)+Y(g) R(g)+Q(g)的平衡常数与温度的关系如下表。830℃时,向一个2L的密闭容器中充入0.2 molX和0.8 mol Y,反应初始4s内v(X)=0.005mol/(L·s)下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如下表。830℃时,向一个2L的密闭容器中充入0.2 molX和0.8 mol Y,反应初始4s内v(X)=0.005mol/(L·s)下列说法正确的是
| A.4s时容器内c(Y)="0.76" mol/L |
| B.830℃达平衡时,X的转化率为80% |
| C.反应达平衡后,升高温度,平衡正向移动 |
D.1 200℃时反应R(g)+Q(g)  X(g)+Y(g)的平衡常数K=0.4 X(g)+Y(g)的平衡常数K=0.4 |
下图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g) 反应过程中能量示意图。
CO2(g)+NO(g) 反应过程中能量示意图。
一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ。下列有关说法正确的是
| A.该反应的焓变△H=234kJ/mol |
| B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 |
| C.若X表示反应时间,则Y表示的可能是混合气体的密度 |
| D.若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
在容积不变的密闭容器中存在如下反应:2A(g)+B(g)  3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
| A.图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响 |
| B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 |
| D.图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高 |
炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2 L的密闭容器中,高温下进行下列反应:C(s)+CO2(g) =2CO(g) ΔH=Q kJ·mol-1。下图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是
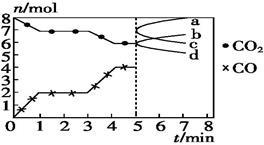
| A.0~1 min,v(CO)=1 mol·L-1·min-1;1~3 min,v(CO)=v(CO2) |
| B.当容器内的压强不变时,反应一定达到平衡状态,P(平衡) /P(起始) < 1 |
| C.3 min时,温度由T1升高到T2,则Q>0,再达平衡时,K(T2)/ K(T1)> 1 |
| D.5 min时再充入一定量的CO,a、b曲线分别表示n(CO)、n(CO2)的变化 |
往1.0 mol·L-1KI溶液中加入固体I2,发生反应:I2(aq)+I-(aq) I3-(aq) △H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是
I3-(aq) △H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是
| A.该反应的△H>0 |
| B.a、c两点对应的I-反应速率相等 |
| C.b点时0~10s I-的平均反应速率为0.04mol·L-1·s-1 |
| D.d点时该反应在对应温度下处于平衡状态 |
合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化。图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化。图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
下列说法正确的是
| A.该反应为自发反应,由图1可得加入适当的催化剂,E和ΔH都减小 |
| B.图2中0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d |
| C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
| D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
在100 ℃时,将0.40 mol二氧化氮气体充入2 L密闭容器中,每隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
下列说法中正确的是
A.反应开始20 s内以二氧化氮表示的平均反应速率为0.001 25 mol·L-1·s-1
B.80 s时混合气体的颜色与60 s时相同,比40 s时的颜色深
C.80 s时向容器中加入0.32 mol氦气,同时将容器扩大为4 L,则平衡将不移动
D.若起始投料为0.20 mol N2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等
根据下列有关图象,说法正确的是
| A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0 |
| B.由图Ⅱ知,反应在t6时刻,NH3体积分数最大 |
| C.由图Ⅱ知,t3时采取增大反应体系压强的措施 |
| D.图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量 |
已知图一表示的是可逆反应CO(g)+H2(g)  C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)  N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.若图一t2时改变的条件是增大压强,则反应的ΔH增大 |
| C.图二t1时改变的条件可能是升高了温度或增大了压强 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是
| A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等 |
| B.溶液酸性越强,R的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1 |
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡。在这过程中,甲容器保持压强不变,乙容器保持体积不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持压强不变,乙容器保持体积不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率
| A.等于P% | B.小于P% | C.大于P% | D.无法判断 |
下列图示与对应的叙述不相符的是( )




| A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80 ℃时KNO3的过饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1盐酸溶液得到的滴定曲线 |
| D.图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是增大压强 |
在100℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,反应过程中浓度变化如下:2NO2(g)  N2O4(g) ΔH <0
N2O4(g) ΔH <0
| 容器 |
物质 |
起始浓度/(mol•L-1) |
平衡浓度/(mol•L-1) |
| Ⅰ |
N2O4 |
0.100 |
0.040 |
| NO2 |
0 |
0.120 |
|
| Ⅱ |
N2O4 |
0 |
0.014 |
| NO2 |
0.100 |
0.072 |
下列说法正确的是
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2)
B. 平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ) = 2K(Ⅱ)
C. 平衡后,升高相同温度,以N2O4表示的反应速率ν(Ⅰ)<ν(Ⅱ)
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
试题篮
()