在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应A(s) + 2B(g)  C(g) + D(g) 已达平衡状态的是
C(g) + D(g) 已达平衡状态的是
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的平均相对分子质量 |
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g) 2S03(g)并达到平衡。在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为a%,乙容器中SO2的转化率为b%,则a与b的关系为
2S03(g)并达到平衡。在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为a%,乙容器中SO2的转化率为b%,则a与b的关系为
| A.a﹥b | B.a=b | C.a﹤b | D.无法确定 |
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g)。平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低0.30mol/L。下列有关判断正确的是
zC(g)。平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低0.30mol/L。下列有关判断正确的是
| A.x+y﹤z | B.平衡向正反应方向移动 |
| C.B的转化率降低 | D.C的体积分数升高 |
在一定条件下NO2与SO2气体发生反应:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8kJ·mol-1
SO3(g)+NO(g) ΔH=-41.8kJ·mol-1
将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明该反应达到平衡状态的是
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 | D.每消耗1molSO3的同时生成1molNO2 |
下列变化不能用勒夏特列原理解释的是
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| B.合成氨工业中使用催化剂,以提高NH3的产量 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
D.CO2(g) CO2(aq)ΔH<0,降温增压可增大二氧化碳气体在水中的溶解度 CO2(aq)ΔH<0,降温增压可增大二氧化碳气体在水中的溶解度 |
可逆反应mA(g) nB(g)+pC(s);△H="Q," 温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图像,以下叙述正确的是
nB(g)+pC(s);△H="Q," 温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图像,以下叙述正确的是
| A.m>n, Q<0 | B.m>n+p,Q>0 |
| C.m>n, Q>0 | D.m<n+p, Q <0 |
经一定时间后,可逆反应aA+bB cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是
cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是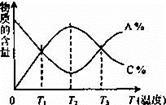
| A.该反应在T1、T3温度时达到化学平衡 |
| B.升高温度,平衡会向正反应方向移动 |
| C.该反应的逆反应是放热反应 |
| D.该反应在T2温度时达到化学平衡 |
对于可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ,下列叙述正确的是
4NO(g)+6H2O(g) ,下列叙述正确的是
| A.达到化学平衡状态时,4v正(O2)=5V逆(NO) |
| B.化学反应速率的关系为2V正(NH3)=3V正(H2O) |
| C.达到化学平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到化学平衡状态 |
一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g)  (H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是
(H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是
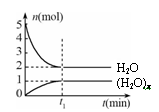
| A.x=3 |
| B.该温度下,反应的平衡常数为0.125 L2/mol2 |
| C.平衡时混合气体的平均摩尔质量是30 |
| D.t1时刻,保持温度不变,再充入1 molH2O(g), |
重新达到平衡时,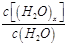
 将增大
将增大
在体积恒定的密闭容器中,一定量的SO2与1.25mol O2在催化剂作用下加热到600℃发生反应:2SO2(g)+O2(g) 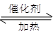 2SO3(g) △H<0。当气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%。下列有关叙述正确的是
2SO3(g) △H<0。当气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%。下列有关叙述正确的是
| A.该温度下的平衡常数为101.25 L/moL |
| B.达到平衡时,SO2的转化率是90% |
| C.降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| D.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为231.4g |
在一个1L的密闭容器中,加入2molA和1molB,发生下述反应: 2A(g) + B(g) 3C(g) + D(s),达到平衡时,C的浓度为1.2mol/L,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2mol/L的是
3C(g) + D(s),达到平衡时,C的浓度为1.2mol/L,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2mol/L的是
| A.1mol A+0.5mol B+1.5mol C+0.1mol D |
| B.3mol C+ 0.5mol D |
| C.2mol A+1mol B+1mol D |
| D.0.5mol A+0.25mol B+2.25mol C |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr(g)
2HBr(g) 平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
| A.a>b | B.a=b | C.a<b | D.无法确定 |
下列能用勒夏特列原理解释的是
A.溴水中存在下列平衡Br2+H2O HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅 HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅 |
| B.工业上由氢气和氮气合成氨是在较高温度下进行的 |
| C.SO2催化氧化成SO3的反应,需要使用催化剂 |
| D.H2、I2、HI平衡混和气加压后颜色变深 |
试题篮
()